Allognon MC, Ayo Bivigou E, Ecke Nzengue JE, Moubamba F
Service de Cardiologie du Centre Hospitalier Universitaire de Libreville
Auteur correspondant : Allognon M. Christian : BP 3324 Libreville, Tél : +241.06.90.60.46 Email : christalog4@yahoo.fr
Résumé
Introduction : L’angor vasospastique (AVS) est une entité clinique rare et de diagnostic complexe.
Objectif : Relever l’apport du Holter-ECG dans le diagnostic de l’AVS.
Cas clinique : I l s ’agissait d ’un p atient d e 4 7 a ns à h aut r isque cardiovasculaire, reçu pour précordialgies et syncopes. L’électrocardiogramme au repos était normal. L’enregistrement Holter avait permis le diagnostic de l’AVS en révélant des accès nocturnes de lésions sous-épicardiques symptomatiques. L’évolution avait été favorable sous inhibiteur calcique avec arrêt du tabagisme.
Conclusion : En l’absence de coronarographie avec test de provocation, l’enregistrement Holter permet le diagnostic de l’AVS lorsqu’il documente l’ischémie myocardique, symptomatique.
Mots clés : Angor vasospastique – Holter ECG – inhibiteur calcique
Summary
Introduction: Vasospastic angina (AVS) is a rare clinical entity and presents a complex diagnosis.
Objective: Confirm the diagnostic contribution in AVS of ambulatory electrocardiographic monitoring.
Case report: T his was a 47- year’s old man with high cardiovascular risk who had chest pain and sometimes syncope. The resting electrocardiogram was normal. The Holter recording was conclusive with nocturnal access of transient, symptomatic, ST – segment elevation. Evolution had been favorable under calcium channel blocker and smoking cessation.
Conclusion: In the absence of provocative coronary artery spasm testing, the Holter recording may allow the diagnosis of AVS when documenting myocardial ischemia.
Key words: Vasospastic angina – Holter recording – Calcium channel blocker
Introduction
L’angor vasospastique (AVS) est une variante d’angine de poitrine dont les symptômes ont la particularité de survenir presque exclusivement au repos en s’accompagnant de modifications électriques per critiques, transitoires (1). L’incidence de cette entité est inconnue et dépend fortement de la population étudiée, (2) avec d’importantes variations géographiques. L’expression clinique est variable : précordialgies, syncopes et mort subite. Il traduit une ischémie myocardique transitoire survenant sur des artères coronaires saines ou avec athérosclérose non obstructive. Le développement du Holter ECG et de la coronarographie a permis d’en comprendre l’origine : le spasme artériel coronaire. L’approche diagnostique de référence actuelle, privilégie les tests de provocation pharmacologique à la coronarographie, qui en pratique sont souvent peu réalisés (2). Le Holter ECG est un enregistrement continu de l’électrocardiogramme de 24 – 72 heures, destiné à mettre en évidence les troubles du rythme ou de la conduction, paroxystiques. L’objectif de cette observation est de souligner l’apport de l’enregistrement Holter dans le diagnostic de l’AVS.
Observation clinique
Il s’agissait d’un homme de 47 ans admis en unité de soins intensifs pour la prise en charge de pertes de connaissance de durée brève, environ une minute, évoluant depuis deux mois. Ces dernières étaient parfois précédées de précordialgies et de palpitations. Ce patient était à haut risque cardiovasculaire du fait d’un tabagisme actif (15 paquets-années), d’une hypertension artérielle (HTA) traitée par l’association ramiprilhydrochlorothiazide et du bisoprolol, d’une obésité majeure (indice de masse corporelle à 34,4 kg/m²) et d’une hypercholestérolémie. A la consultation initiale, un épisode syncopal était survenu au cours de l’examen clinique. L’examen physique percritique était sans particularité avec un retour rapide à la conscience en quelques secondes. En postcritique, l’examen était normal avec une pression artérielle à 120/85 mmHg et une fréquence cardiaque à 75 battements/min. L’électrocardiogramme postcritique était également normal inscrivant un rythme sinusal régulier à 80 battements/min (figure 1).

Figure 1: Électrocardiogramme de surface en post-critique
L’échocardiographie Doppler retrouvait une cardiomyopathie hypertrophique concentrique avec une masse ventriculaire gauche indexée de 120 g/m2 et une épaisseur pariétale relative à 0,48. La fonction systolique ventriculaire gauche était normale avec des pressions de remplissage normales. Il n’y avait pas d’obstacle à l’éjection ventriculaire. L’enregistrement Holter des 24 heures avait mis en évidence seize périodes de lésion sous-épicardique paroxystiques, à prédominance nocturne, avec un sus-décalage du ST variant entre 0,2 et 0,5 mv. Ces accès de modification du ST, symptomatiques (précordialgies, syncopes), duraient en moyenne trois minutes et étaient parfois concomitants d’un bloc auriculo-ventriculaire du deuxième degré Mobitz 2 (figure 2a, 2b et 2c). Le diagnostic d’un angor vasospastique a donc été retenu.
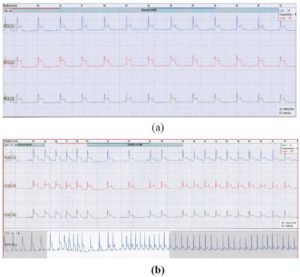
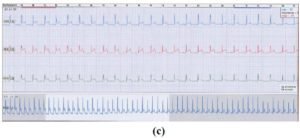
Figure 2 : Enregistrement Holter ECG des 24 heures, montrant une lésion sous-épicardique associée à un bloc auriculo-ventriculaire du 2ème degré Mobitz 2 en (a) et (b) avec retour progressif à la normale en (c).
Un traitement à base de 10 mg d’amlodipine par jour avait été instauré en remplacement du précédent, notamment l’arrêt des bétabloquants. Un antiagrégant plaquettaire et une statine étaient associés du fait du haut risque cardiovasculaire. L’évolution était marquée par la disparition complète des syncopes et des précordialgies au bout de deux semaines. La coronarographie réalisée un mois plus tard, concluait à une plaque intermédiaire du tronc commun estimée à 50%. Le test de provocation n’avait pas été effectué. L’exploration électrophysiologique endocavitaire était normale. L’arrêt du tabac a été obtenu après sensibilisation du patient et de son entourage. Un an après cette prise en charge, le patient était toujours asymptomatique.
Discussion
Les prévalences de l’AVS rapportées dans lalittérature sont très variables d’une région à l’autre. Considéré comme rare en Europe et en Amérique du nord (3), il ne concernerait que 1,2% des patients dans une étude européenne (4), et semble plus fréquent au Japon avec une prévalence de 40% (5). En effet, des prédispositions ethniques, particulièrement en population asiatique (6), ont été décrites. Chez les patients mélanodermes, peu de données sont disponibles sur l’AVS. Thiam à Dakar avait rapporté un seul cas sur une série de 77 patients suivis pour cardiopathie ischémique (7). Au Maghreb, Bouzerda rapportait un cas d’angine spastique chez un sujet tabagique de 40 ans (8).
Aussi, le diagnostic d’AVS paraît-il-complexe et les variations de prévalence observées d’une région à l’autre pourraient également relever de la stratégie diagnostique retenue. La coronarographie avec test de provocation demeure l’examen clé du diagnostic. Dans une récente étude italienne, ces tests étaient positifs chez 46,2% de patients explorés pour infarctus du myocarde sans sténose significative des coronaires (9). Mais, l’accès à la coronarographie n’est pas toujours aisé, en particulier au Gabon et dans d’autres régions d’Afrique sub-saharienne. L’enregistrement Holter peut dans ce contexte, constituer une alternative aux tests de provocation, en présence de symptômes évocateurs tels que décrits chez ce patient. En effet, les critères diagnostiques actuels (de la Japanese Circulation Society de 2013 et ceux plus récents du COVADIS : Coronary Vasomotion Disorders International Study Group) impliquent trois considérations que sont : les manifestations cliniques classiques de l’AVS, la documentation de l’ischémie myocardique au cours d’épisodes spontanés et la démonstration du spasme de l’artère coronaire (5,10). Toutefois, ces critères diagnostiques précisent, qu’en présence de symptômes classiques, l’existence d’un sus-décalage du segment ST concomitant sur un Holter ECG, bien que rare, permet de poser le diagnostic de l’AVS, comme établi dans cette observation. Le recours aux tests de provocation à la coronarographie n’est dans cette situation plus nécessaire. La coronarographie, réalisée secondairement chez ce patient à haut risque cardiovasculaire, avait pour but de rechercher d’éventuelles lésions coronaires associées qui pourraient nécessiter une prise en charge instrumentale. Le tabagisme, tel que relevé chez ce patient, est de loin le facteur de risque le plus important et classiquement incriminé dans l’AVS (5). Certains médicaments tels que les sympathomimétiques, les béta-bloquants (comme dans la présente observation), les parasympathomimétiques et les alcaloides de l’ergot ont aussi été décrits comme facteurs déclenchants des crises (2).La syncope, symptôme initial chez ce patient, est une manifestation classique de l’AVS. Elle témoigne du caractère potentiellement dangereux de cette entité qui peut également se manifester par une mort subite (11, 12). Elle pourrait s’expliquer par des troubles du rythme et/ou de la conduction, voire des spasmes multiples entraînant une asystolie (13).
L’évolution sous inhibiteur calcique est souvent favorable (14) tel que relevé dans ce cas clinique. Cette classe thérapeutique, associée aux modifications du mode de vie, constitue le traitement de première intention selon les recommandations de la Société Européenne de Cardiologie (15). Les statines sont également indiquées en plus de ce traitement ; elles joueraient un rôle primordial dans la prévention des récidives angineuses (16). Il existe en effet, des possibilités de récidive sous traitement. Il s’agit des cas d’angor spastique réfractaire avec risque de mort subite (17) dont la proportion est de 13,7% selon les registres japonais (5). Cette forme particulière serait surtout l’apanage des sujets jeunes, grands fumeurs et le plus souvent normotendus (5). L’arrêt du tabac a été obtenu après sensibilisation de ce patient et de son entourage. Le risque de récidive semble faible chez ce dernier.
Conclusion
L’AVS est une pathologie dont le diagnostic est peu aisé. En présence de symptômes cliniques évocateurs, l’enregistrement Holter peut constituer une alternative aux tests de provocation à la
coronarographie, lorsque celle-ci n’est pas accessible.
Contribution des auteurs
Allognon M. Christian a rédigé le document complet ; Ayo Bivigou Elsa a procédé à la revue de la bibliographie ; Moubamba Franck a sélectionné l’iconographie ; Ecke Nzengué Jean-Emmanuel a corrigé le manuscrit définitif.
Références
2. Picard F, Sayah N, Spagnoli V, et al. Vasospastic angina: A review of current evidence. Archives of Cardiovascular Disease 2019; 112: 44-55.
3. Halna du Fretay X, Blanchard-Lemoine B, Schnebert B, et al. Angor spastique : quel regard en 2011 ? Annales de Cardiologie et d’Angéiologie 2011; 60: 317–23.
4. Lanza G, Sestito A, Sgueglia GA, et al. Current clinical features, diagnostic assessment and prognostic determinants of patients with variant angina. Int J Cardiol 2007; 118: 41-7.
5. Scientific Committee of the Japanese Circulation Society. Guidelines for Diagnosis and Treatment of Patients With Vasospastic Angina (Coronary Spastic Angina) (JCS 2013)–Digest Version- Circ J 2014; 78: 2779 – 801.
6. Pristipino C, Beltrame JF, Finocchiaro ML, et al. Major racial differences in coronary constrictor response between japanese and caucasians with recent myocardial infarction. Circulation 2000;101:1102-8.
7. Thiam M, Cloatre G, Fall F, et al. Cardiopathies ischémiques en Afrique: expérience de l’Hôpital Principal de Dakar. Med Afr Noire 2000; 47:281-4.
8. Bouzerda A, Khatouri A. Angor vasospastique. A propos d’une observation et revue de la littérature. Médecine du Maghreb 2016; 238:40-4.
9. Montone RA, Niccoli G, Fracassi F, et al. Patients with acute myocardial infarction and non-obstructive coronary arteries: safety and prognostic relevance of invasive coronary provocative tests. Eur Heart J 2018; 39:91-8.
11. Ahmed F, Marc-Alexander O, Bettina K. A case of Prinzmetal angina diagnosed by Holter monitoring who survived a sudden cardiac death: Case report. Journal of Cardiology Cases 2012; 6: 88- 90.
12. Halna du Fretaya X, Mohammed Saeeda D, Benamer H. Mort subite et angor spastique : quelle stratégie diagnostique et thérapeutique ? Annales de Cardiologie et d’Angéiologie 2014;63: 465–70.
13. Lablanche JM. Le spasme coronaire existe-t-il encore ? Consensus cardio pour le praticien 2011; 73: 22-3.
14. Nakad G, and Bayeh H. Unusual Vasospastic Angina: A Documented Asymptomatic Spasm with Normal ECG—A Case Report and a Review of the Literature. Case Rep Cardiol 2013. doi:10.1155/2013/407242.
15. Roffi M, Patrono C, Collet JP, et al. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: Task Force for the Management of Acute Coronary Syndromes in Patients Presenting without Persistent ST-Segment Elevation of the European Society of Cardiology (ESC). Eur Heart J 2016;37: 267-315.
16. Ishii M, Kaikita K, Sato K, et al. Impact of Statin Therapy on Clinical Outcome in Patients With Coronary Spasm. J Am Heart Assoc 2016:5
17. Romain E, Géraud S, Frédéric J. Should an implanted defibrillator be considered in patients with vasospastic angina? Archives of Cardiovascular Disease 2014; 107: 42-7.