Abouki COA1,2, Kerekou CA2,3, Doutetien Djossou A2, Aïgbè N1,3, Djohossou GJ4, Alamou S1,2, Odoulami L1,5, Sounouvou I1,6, Tchabi S1,2
1. Unité d’Enseignement en Ophtalmologie – Faculté des Sciences de la Santé de l’Université d’Abomey-Calavi
2. Centre National Hospitalier Universitaire/Hubert Koutoukou MAGA (CNHU/HKM) de Cotonou
3. Unité d’Enseignement en Endocrinologie – Faculté des Sciences de la Santé de l’Université d’Abomey-Calavi
4. Hôpital d’Instruction des Armées – Centre Hospitalier Universitaire de Cotonou
5. Centre Hospitalier Universitaire de Zone / Suru- Léré (CHUZ/SL)
6. Centre Hospitalier Universitaire Départemental de l’Ouémé Plateau (CHUD/OP)
Auteur correspondant : Abouki COA ; e.mail : oladouke@gmail.com.
Résumé
But : analyser les facteurs associés à la survenue de la rétinopathie diabétique au Centre National Hospitalier Universitaire – Hubert Koutoukou MAGA (CNHU-HKM).
Patients et méthode : il s’agissait d’une étude transversale descriptive et analytique avec un recueil prospectif des données. Elle s’était réalisée sur une période de trois mois allant du 10 Juillet au 10 Octobre 2019. Elle a concerné tous les patients souffrant du diabète sucré et ayant consulté dans le service d’Endocrinologie, et bénéficié d’un examen ophtalmologique systématique dont le fond d’oeil, au cours de la période d’étude.
Résultats : la fréquence de la rétinopathie diabétique était de 30,46% (53/174 patients). Une prédominance féminine était observée avec une sex-ratio (H/F) de 0,57. Les principaux facteurs de risque modifiables étaient représentés par la profession et ceux non modifiables étaient représentés par la présence d’une néphropathie ancienne, l’hémoglobine glyquée, l’âge de découverte du diabète et son ancienneté.
Conclusion : La rétinopathie diabétique demeure une affection fréquente dans nos régions. Sa prévention impose une sensibilisation axée sur les facteurs de risque afin de réduire la cécité due à cette affection.
Mots clés : facteurs associés, modifiables ou non, rétinopathie diabétique.
Abstract
Aim : to analyze the risks factors associated with the occurrence of diabetic retinopathy at the National University Hospital Center – Hubert Koutoukou MAGA (CNHU-HKM).
Patients and method : this was a descriptive and analytical cross-sectional study with prospective data collection. It was carried out over a three-month period from July 10 to October 10, 2019. It concerned all patients suffering from diabetes mellitus and who consulted in the Endocrinology department during the study period.
Results : the frequency of diabetic retinopathy was 30.46% (53/174 patients). A female predominance was observed with a sex ratio (M/F) of 0.57. The main modifiable risk factors were represented by occupation and those that were not modifiable were represented by the presence of old nephropathy, glycated hemoglobin, age of discovery of diabetes and its length of service.
Conclusion : Diabetic retinopathy remains a frequent condition in our regions. Its prevention requires awareness focused on risk factors in order to reduce blindness due to this condition.
Key words : associated factors, modifiable or not, diabetic retinopathy.
Introduction
La rétinopathie diabétique (RD) est l’une des complications microvasculaires du diabète. Elle constitue un problème de santé publique [1]. Selon la Fédération Internationale du Diabète (FID), environ un tiers des personnes atteintes du diabète développent une RD [2]. En Afrique, les données de la littérature situent la prévalence globale de la RD à 30% (15% -52% des personnes diabétiques) [3]. Elle est une cause majeure de malvoyance et c’est la première cause de cécité avant l’âge de 55 ans [4]. Le coût de la RD avant le stade de cécité est relativement faible par rapport à celui des autres complications du diabète. Cependant, le coût de la cécité est beaucoup plus élevé, et se situe au niveau des complications les plus coûteuses du diabète [5]. Il apparaît donc important de connaître les facteurs liés à la survenue de la RD pour mieux les contrôler afin de réduire la prévalence de cette affection.
Patients et méthodes
Il s’agissait d’une étude transversale à visée descriptive et analytique avec un recueil prospectif des données. Elle s’était réalisée sur une période de trois mois allant du 10 Juillet au 10 Octobre 2019. Elle était représentée par un ensemble de patients souffrant du diabète sucré et ayant consulté dans le service d’Endocrinologie au cours de la période d’étude. Les patients âgés de 18 ans au moins, atteints de diabète sucré (type 1 ou 2), ayant consulté dans le service d’Endocrinologie du CNHU-HKM, bénéficiant d’un examen du fond d’oeil dans le service d’Ophtalmologie et consentant à l’étude. Tous les patients présentant une cécité unie ou bilatérale et les femmes en état de grossesse. Un recrutement exhaustif de tous les patients répondant à nos critères d’étude a été réalisé. La variable dépendante était représentée par la rétinopathie diabétique. Les variables indpandantes concernaient les facteurs de risque non modifiables qui étaient l’âge, le sexe, le type de diabète, l’ancienneté du diabète, l’âge de début du diabète, l’antécédent familial de diabète et d’hypertension artérielle. Les facteurs de risque modifiables tels que le niveau d’instruction, la profession, le surpoids, l’obésité et l’obésité abdominale, l’alcoolisme, le tabagisme, l’inactivité physique, la néphropathie ancienne ou en cours, la neuropathie ancienne ou en cours, le traitement à base d’insuline, d’antidiabétiques oraux (ADO) et de tisanes, le déséquilibre du diabète (hémoglobine glyquée > 7%), l’hypercholestérolémie LDL et totale, l’hypertriglycéridémie et la présence d’une microal-buminurie des 24h significative. La collecte des données était effectuée par un questionnaire et d’un smartphone sur lequel était installé le logiciel Kobo-collect pour l’enregistrement des données. L’analyse des données a été faite avec le logiciel SPSS version 25.0. Les proportions ont été calculées pour les variables qualitatives. Les moyennes et les écarts types ont été calculés pour la description des variables quantitatives. Une analyse bivariée a été réalisée pour l’identification des facteurs associés. La comparaison des proportions a été faite grâce aux tests de Fisher, du Chi2 de Yates et du Chi2 de Pearson. Le test de Fisher a été considéré lorsque le plus petit effectif théorique était inférieur ou égal à 3, le Chi2 de Yates quand il est supérieur à 3 et inférieur ou égal à 5 et le Chi2 de Pearson quand il est strictement supérieur à 5. La différence était statistiquement significative pour une p-value inférieure à 0,05. La force de l’association a été appréciée à l’aide de l’Odds Ratio (OR) et de son intervalle de confiance à 95% (IC95%OR). Les tableaux et les figures ont été réalisés avec les logiciels Microsoft Office Word et Excel version 2016. Le consentement oral, libre et éclairé des patients était obtenu. Toutes les données recueillies sous anonymat au cours de l’enquête n’avaient servi que dans le cadre de cette étude et étaient restées strictement confidentielles. La difficulté rencontrée
était liée à l’incapacité des patients à honorer les rendez-vous en ophtalmologie.
Résultats
Au total, 174 sujets ont été inclus parmi lesquels 53 avaient une RD, soit une fréquence de 30,46%. Le tableau I présente la répartition de la RD en fonction des données socio-épidémiologiques.
La profession était le seul facteur sociodémographique modifiable associé à la survenue de la RD (p꞊0,035). Les personnes retraitées (odds ratio à 13,51 avec un intervalle de confiance compris entre 1,70 et 107,25) ainsi que les employés (odds ratio à 11,51 avec un intervalle de confiance compris entre 1,42 et 92,74) étaient les plus atteints de RD. Il n’existait pas d’association statistiquement significative entre les facteurs comportementaux et la survenue d’une RD. Il existait une association statistiquement significative entre la RD et l’existence d’une néphropathie ancienne ou en cours (p=0,024). Les patients qui présentaient une néphropathie qu’elle soit récente ou ancienne étaient plus susceptibles de faire une RD que les autres (odds ratio à 4,02 avec un intervalle de confiance de [1,13- 14,22]). Par contre, il n’existait pas d’association statistiquement significative entre le traitement antidiabétique et la RD. Il n’y a pas d’association statistiquement significative entre ces facteurs et l’existence d’une rétinopathie diabétique.
Il existait une association significative entre la rétinopathie diabétique et l’hypertension artérielle (p=0,002). La RD était beaucoup plus fréquente chez les personnes hypertendues (odds ratio à 3,45 avec un intervalle de confiance de [1,49-7,96]).
L’ancienneté du diabète était significativement associée à la survenue d’une RD (p<0,001). Les sujets diagnostiqués diabétiques depuis plus de 5 ans étaient plus affectés par la RD que les autres (odds ratio à 5,02 avec un intervalle de confiance de [2,39- 10,50]). L’existence d’un lien statistiquement significatif était également notée entre l’âge de découverte du diabète et la RD (p=0,029). Les patients dont l’âge était inférieur ou égal à 48 ans au moment du diagnostic du diabète étaient les plus touchés par cette affection (odds ratio à 2,07 avec un intervalle de confiance de [1,06-4,04]), comme spécifié dans le tableau II.

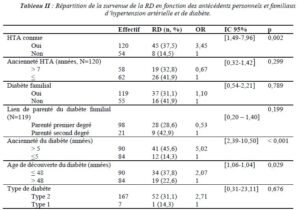
Le déséquilibre glycémique était fortement associé au développement de la RD (p<0,001). Les personnes qui avaient une hémoglobine glyquée ≥ 7% étaient les plus concernées par cette affection (odds ratio à 3,36 avec un intervalle de confiance de [1,60-7,04]). Il existait une association entre la microalbuminurie des 24 heures et l’existence d’une RD. Les sujets chez qui la microalbuminurie des 24h est significative (> 30 mg) étaient plus susceptibles de faire une RD (p=0,066). A contrario, Il n’existait pas une association statistiquement significative entre l’âge, le sexe, l’ethnie et la RD (tableau III).

Discussion
La fréquence de la RD était de 30,46% dans notre étude. Elle est proche des 33% de Nwosu et al. [6] au Nigéria en 2000 et des 36,6% de Tchabi et al. [7] au Bénin en 2012. Toutefois, Abouki et al. [8] au Bénin en 2016, Kouassi et al. [9] en Côte-d’Ivoire en 2018 et Diallo et al. [10] au Burkina-Faso en 2014 ont trouvé des fréquences plus élevées respectivement de 43,33%, 45% et 47,1%. Rajoana et al. [11] en 2016 à Madagascar ont rapporté une fréquence plus élevée de 65,8%. Ces résultats illustrent l’importance de la RD au sein de nos populations et appellent à axer nos actions sur des mesures préventives. En revanche, Magulike et al. [12] en 2003 au Nigéria, Omolase et al. [13] en 2010 au Nigéria, Assavedo et al. [14] en 2016 au Bénin, Djagadou et al. [15] en 2017 au Togo et Maammar et al. [16] en 2013 en Algérie ont trouvé des fréquences plus faibles respectivement 12,75%, 15%, 17,46%, 22,73% et 25,37%. La disparité de ces fréquences peut être liée à la différence de taille et aux techniques d’échantillonnage qui diffèrent d’une étude à une autre. Dans notre étude, la fréquence de la RD était légèrement plus élevée chez les personnes ayant un bas niveau d’instruction (non scolarisé/primaire) que chez les autres (35,71% contre 28,79%). Ce résultat concorde avec celui de Abouki et al. [8] à Porto-Novo au Bénin en 2016 qui a rapporté que cette affection était prédominante chez les analphabètes (55,36%) et les sujets avec un niveau d’instruction primaire (45,45%). En revanche, Cui et al. [17] en Chine en 2019 avaient noté que la RD était majoritairement présente chez les personnes avec un niveau d’instruction élevé (secondaire/supérieur), soit 51,9%. Dans tous les cas, le niveau d’instruction n’est pas un facteur de risque de la RD (odds ratio à 1,37 avec un intervalle de confiance à 95% compris entre 0,65 et 2,86 ; p=0,395). Certains auteurs ont trouvé une proportion plus élevée de la RD chez les personnes sansemplois. C’est le cas de Abouki et al. [8] à Porto- Novo au Bénin (57,14%) en 2016 et de Ben et al. [18] en Tunisie (40%) en 2016. Ce résultat pourrait s’expliquer par la situation sociale des personnes sans-emplois qui n’arrivent pas à subvenir à une prise en charge correcte et efficiente de leur affection. Il ressort de cette étude que la profession constitue un facteur de risque de la RD (pour les retraités, odds ratio à 2,02 avec un intervalle de confiance à 95% compris entre 1,04 et 3,93 ; p=0,035).
La fréquence de la RD était plus élevée chez les sujets sous insuline (45,45%). Le même constat a été fait par Pirie et al. [19] en 2014 en Afrique du Sud. En 2012 au Rwanda, Giraneza et al. [20] quant à eux, ont rapporté une proportion inférieure à la nôtre, soit 37,17%. Ces différences pourraient s’expliquer par les tailles des échantillons de ces études. Le régime de traitement n’est pas un facteur de risque de la RD (odds ratio à 1,97 avec un intervalle de confiance à 95% compris entre 0,79 et 4,95 ; p=0,395). La RD était plus représentée chez les personnes qui avaient une néphropathie diabétique à 41,18% (contre 14,81%). Ce résultat est similaire à celui de Assavedo et al. [14] à Parakou au Bénin en 2014 qui rapportent que 21,9% (contre 5,8%) des sujets présentant une néphropathie diabétique développaient parallèlement une RD, mais aussi à celui de He et al. [21] en Chine (43,06% contre 25,33%) en 2012. Toutefois, Rasoulinejad et al. [22] en Iran en 2015 ont objectivé que la RD était présente à proportion presque égale chez les patients déjà au stade de néphropathie diabétique (67,74%) et chez ceux qui ne le sont pas (64,53%). Cependant, la néphropathie diabétique constitue un facteur de risque de la RD (odds ratio à 4,02 avec un intervalle de confiance à 95% compris entre 1,13 et 14,22 ; p=0,024).
La RD était présente chez 40,96% des patients ayant un mauvais équilibre glycémique. Ce même constat a été fait par Djrolo et al. [23] au Bénin (94,6%) en 2014, Lopez et al. [24] en Espagne (16,82%) en 2017. Une étude de l’UKPDS chez les diabétiques de type 2 a démontré le rôle du déséquilibre glycémique dans l’incidence et la progression de la RD [25]. Le déséquilibre du diabète est bel et bien un facteur de risque de la RD (odds ratio à 3,36 avec un intervalle de confiance à 95% compris entre 1,60 et 7,04 ; p<0,001).
La RD était dans notre étude majoritairement présente à 39,39% chez les diabétiques qui avaient une microalbuminurie significative (> 30 mg/24h). Ce résultat est comparable à ceux de Abouki et al. [8] à Porto-Novo au Bénin (66,67%) en 2016 et de Berkia et al. [25] au Maroc (53,1%) en 2014 mais à des proportions supérieures. Toutefois, la microalbuminurie ne constitue pas un facteur de risque de la RD (odds ratio à 2,99 avec un intervallede confiance à 95% compris entre 0,90 et 9,85 ; p=0,066).
Facteurs de risque non modifiables
La RD était plus fréquente dans le diabète de type 2 dans notre étude à 31,14% contre 14,29%. En effet, elle survient en général après 7 ans d’évolution du diabète chez les diabétiques de type 1, et 20% des diabétiques de type 2 l’avaient lors de la découverte de leur diabète [26]. Toutefois, en 2015 à Rabat au Maroc, Andaloussi et al. [27] ont obtenu les résultats similaires pour les deux types de diabète (40,5% pour le type 1 et 38,9% pour le type 2) en ce qui concerne la survenue de cette affection. Cependant, le type de diabète n’est pas un facteur de risque de la RD (odds ratio à 2,71 avec un intervalle de confiance à 95% compris entre 0,31 et 23,11 ; p=0,676).
De nombreuses études ont montré une augmentation de la fréquence de la RD avec l’ancienneté du diabète. Mallika et al. [28] ont noté en Malaisie en 2011 un développement plus rapide de la RD lorsque l’ancienneté du diabète est supérieure à 15 ans. Cui et al. [17] en Chine en 2019 ont retrouvé comme proportions de RD 15,02%, 43,59% et 66,67% respectivement chez les sujets diagnostiqués depuis moins de 05 ans, de 05 à 10 ans et de plus de 10 ans. L’ancienneté du diabète est donc un facteur de risque de la RD (odds ratio à 5,02 avec un intervalle de confiance à 95% compris entre 2,39 et 10,50 ; p<0,001).
Les personnes diagnostiquées diabétiques plus jeunes (≤ 48 ans) présentaient plus de RD (37,78%). Ce résultat est superposable à celui obtenu en 2016 par Zou et al. [15] en Chine qui ont constaté que l’âge jeune de découverte du diabète (< 45 ans) est un facteur favorisant le développement de la RD. A l’opposé, Ahmed et al. [29] en 2016, en Arabie Saoudite ont relevé que la RD était plus fréquente lorsque l’âge de découverte du diabète était supérieur à 45 ans (70,6% contre 58%). Cette différence pourrait s’expliquer par le fait que cette étude n’a pris en compte que les diabétiques de type 2. Ainsi, l’âge de découverte du diabète est un facteur de risque de la RD (odds ratio à 2,07 avec un intervalle de confiance à 95% compris entre 1,06 et 4,04 ; p=0,029).
Au vu de la littérature, il existe un lien étroit entre la RD et l’hypertension artérielle. Selon une étude de l’UKPDS (United Kingdom Prospective Diabetes Study), une équilibration stricte de la pression artérielle chez les diabétiques de type 2 était hautement bénéfique parce qu’elle permettrait de réduire l’incidence des complications microvasculaires de 37% et de réduire la progression de la RD de 34% [9]. Au Sénégal en 2008, De Médeiros-Quenum et al. [30] ont noté que 77,77% des hypertendus présentaient une RD. Inversement, à Porto-Novo au Bénin en 2016, Abouki et al. [8] ont objectivé que 50% des diabétiques non hypertendus développaient une RD alors que 40,91% des hypertendus étaient atteints. Dans notre étude, la RD était plus retrouvée chez les hypertendus que chez les non-hypertendus (37,50% contre 14,81%). L’hypertension artérielle est également un facteur de risque de la RD (odds ratio à 3,45 avec un intervalle de confiance à 95% compris entre 1,49 et 7,96 ; p=0,002).
Conclusion
La rétinopathie diabétique est une affection grave pouvant conduire au stade ultime, à la cécité. La fréquence de la RD reste élevée et nécessite la prise en compte des facteurs de risque dans le suivi des diabétiques afin de prévenir cette cause de cécité évitable. La prévention et la promotion de la santé oculaire oculaires imposent une sensibilisation à grande échelle sur ces facteurs de risque identifiés dans notre contexte.
Références
2. Ogurtsova K, da Rocha Fernandes JD, Huang Y, Linnenkamp U, Guariguata L, Cho NH, et al. IDF Diabetes Atlas : Global estimates for the prevalence of diabetes for 2015 and 2040. Diabetes Res Clin Pract 2017;128:40‑50.
3. Sidibe E. Rétinopathie diabétique à Dakar et revue de la littérature africaine. Diabetes Metab J 2000; 26(4):322‑4.
4. Ridouane S, Ouhdouch F, Diouri A. Profil épidémiologique, clinique, thérapeutique et évolutif de la rétinopathie diabétique à Marrakech. Diabetes Metab J 2009;35(1):A33. Doi : 10.1016/S1262-3636(09)71818-X.
5. Haute Autorité de Santé. Dépistage de la rétinopathie diabétique par lecture différée de photographies du fond d’oeil. Saint-Denis : HAS ; 2010.
6. Nwosu SNN. Diabetic Retinopathy in Nnewi, Nigeria. Nigerian Journal ofOphthalmology 2000;8(1) :7‑10.
7. Tchabi S, Assavedo R, Affo Y, et al. Biochemistry’s risks factors on the appearance of diabetic retinopathy in theOphthalmology Department Hospital Center of Borgou, Benin. Revue de Médecine et de Pharmacie. 2012;2(1):137‑42.
8. Abouki C, Alamou S, Wanvoegbe A, et al. Aspects épidémiologiques de la rétinopathie diabétique au CHUD/OP de Portonovo. Cahiers du CBRST 2016;(10) :80‑8.
9. Kouassi FX, Koman CE, Kra ANS, et al. Epidemiological Features of Diabetic Retinopathy in Abidjan (Côte d’Ivoire) : A Study about 448 Patients. Open J Ophthalmol 2018;8(03):140‑9.
10. Diallo J, Dolo M, Sanou J, et al. Que savons-nous de la rétinopathie diabétique au Centre Hospitalier Universitaire Sourô Sanou de Bobo-Dioulasso (CHUSS) ? J Fr Ophtalmol 2019;42(4):361‑7.
11. Rajaona RA, Volamarina RF, Andriamahenina AM, et al. Aspect épidémiologique de la rétinopathie diabétique, étude bicentrique à Antananarivo (Madagascar), à propos de 158 cas. J Fr Ophtalmol 2016;39(5):e137‑8.
12. Magulike NO, Chuka-Okosa CM, Oli JM. Diabetic Eye Disease in Enugu South-Eastern Nigeria – A Preliminary Report. Nigerian Journal of Ophthalmology 2003;11(1):30‑3.
13. Omolase CO, Adekanle O, Owoeye JFA, et al. Diabetic retinopathy in a Nigerian community. Singapore Med J 2010;51(1):56‑9.
14. Assavedo A, Codjo L, Alassani A, et al. Risk Factors of Retinopathy Among Diabetic’s Patients in Benin in 2014 J Ophtalmol Clin Res 2016;3(3):1‑5.
15. Maammar F, Snoussaoui Y, Benhedji F, et al. Facteurs de risque de la rétinopathie diabétique à Tlemcen. Diabetes Metab J 2014;40(1):A86. Doi : 10.1016/S1262-3636(14)72538-8.
16. Djagadou KA, Balaka A, Tchamdja T, etal. Diabete chez le sujet agé au Togo. J Rech Sci Univ 2017;19(3):363‑7.
18. Ben Ahmed I, Houes Rehaiem K, Tounsi H, et al. Étude épidémiologique descriptive des diabétiques de type 1 dans la région de Nabeul en Tunisie. Ann Endocrinol 2016;77(4):498‑528.
19. Pirie FJ, Maharaj S, Esterhuizen TM. Retinopathy in subjects with type 2 diabetes at a tertiary diabetes clinic in Durban, South Africa : Clinical, biochemical and genetic factors. J Clin Transl Endocrinol 2014;1(1):e9‑12.
20. Giraneza R, Semanyenzi S. Risk factors and prevalence of diabetic retinopathy in adult diabetic patients consulting at Kigali university teaching hospital. Rwanda Medical Journal 2012;70(3):14‑9.
21. He B-B, Wei L, Gu Y-J, et al. Factors associated with diabetic retinopathy in chinese patients with type 2 diabetes mellitus. Int J Endocrinol 2012;2012(5):1‑8.
22. Rasoulinejad A, Hajian-Tilaki K, Mehdipour E. Associated factors of diabetic retinopathy in patients that referred to teaching hospitals in Babol. Caspian J Intern Med 2015;6(4):224‑8.
23. Djrolo F, Paraïso NM, Diarra O, et al. Diabetes complications and associated factors in type 2 diabetic patients in Cotonou. J Diabetes Mellitus. 2014 ;4(4) : 311‑5. Doi : 10.4236/jdm.2014.44043.
24. López M, Cos FX, Álvarez-Guisasola F, et al. Prevalence of diabetic retinopathy and its relationship with glomerular filtration rate and other risk factors in patients with type 2 diabetes mellitus in Spain. J Clin Transl Endocrinol 2017;9:61‑5.
25. Berkia I, Gharbi MEH, Chraïbi A, et al. La microalbuminurie : s’agit-il d’un facteur de risque épidémiologique de la rétinopathie diabétique (à propos de 79 cas). Ann Endocrinol 2014;75(5‑6):374. doi : 10.1016/j.ando.2014.07.347.
26. Chaine G, Massin P. Rétinopathie diabétique. Dans : Ophtalmologie. Paris : Inter Med ; 2000. p. 207‑16.
27. Andaloussi Z, Rezzoug B, Loudghiri M, et al. Prévalence de la rétinopathie diabétique et facteurs de risque associés dans la région de Rabat. Journal de la Société Marocaine d’Ophtalmologie 2015;(24) :10‑4.
28. Mallika P, Lee P, Cheah W, et al. Risk factors for diabetic retinopathy in diabetics screened using fundus photography at a primary health care setting in east Malaysia. Malays Fam Physician 2011;6(2‑3):60‑5.
29. Ahmed RA, Khalil SN, Al-Qahtani MAA. Diabetic retinopathy and the associated risk factors in diabetes type 2 patients in Abha, Saudi Arabia. J Family Community Med2016;23(1):18‑24.
30. De Médeiros-Quénum MD, Ndiaye PA, Cissé A, et al. Aspects épidémiologiques et angiofluorographiques de la rétinopathie diabétique au Sénégal. J Fr Ophtalmol 2003;26(2):160‑3.