Mougougou A1, Massandé Mouyendi J1, Ndang Ngou Milama S1, Diao B2.
1- Service d’Urologie, Centre Hospitalier Universitaire de Libreville – Gabon
2- Service d’Urologie-Andrologie, Centre Hospitalier Universitaire Aristide Le Dantec Dakar-Sénégal.
Correspondance : Dr Adrien MOUGOUGOU
E-mail : mougougouadrien@yahoo.fr
Tél : (00241) 04893973
Résumé
Introduction: Le cancer de la prostate demeure un problème de santé publique chez les hommes.Chez les sujets jeunes, les études ayant analysé son pronostic ont abouti à des résultats contradictoires.L’objectif de notre travail était d’étudier les aspects épidémiologiques, diagnostiques, thérapeutiques et pronostiques du cancer de la prostate chez les sujets de moins de 56 ans au service d’Urologie-Andrologie du Centre Hospitalier Universitaire Aristide Le Dantec de Dakar.
Patientes et méthodes : Il s’agissait d’une étude prospective sur 12 patients âgés de moins de 56 ans, suivis pour cancer de la prostate de Janvier 2010 à Décembre 2012 au service d’Urologie-Andrologie du Centre Hospitalier Universitaire Aristide Le Dantec de Dakar. Les paramètres étudiés étaient l’âge, les comorbidités, l’état général, les antécédents familiaux de cancer de la prostate, le toucher rectal, le taux de PSA, l’histologie, le score de Gleason, le bilan d’extension, les différents traitements et leurs résultats.
Résultats: douze patients ont été inclus. L’âge moyen était de 51,8 ± 2,5 ans. Trois patients avaient un antécédent familial de cancer prostatique. Le taux de PSA moyen était de 557,3 avec des extrêmes de 2,5 et 5000 ng/ml. Huit patients présentaient un cancer prostatique métastasé. Un patient avait été mis sous surveillance active, 3 avaient eu une prostatectomie radicale et 8 avaient eu une hormonothérapie. Quatre patients (33,3%) étaient décédés.
Conclusion: Le cancer de la prostate chez les sujets de moins de 56 ans a un mauvais pronostic dans notre pratique. Il nécessite un diagnostic plus précoce.
Mots clés: prostate, cancer, âge, pronostic.
Abstract
Introduction: the prostate cancer remains public problem at the men. At the young subjects, the studies having analyzed its prognostic led to contradictory results. T he o bjective o f o ur work was t o s tudy t he a spects epidemiologic, diagnostic, therapeutic and prognostic of the prostate cancer at the subjects of less than 56 years to the service of Urology and Andrology of Aristide Le Dantec University Hospital of Dakar.
Patients and method: This is a retrospective study on 12 patients with less than 56 years old, followed for prostate cancer from January 2010 to December 2012 to the service of Urology and Andrology of Aristide Le Dantec University hospital of Dakar. The studied parameters were the age, the families’ antecedents of prostate cancer, the rectal examination, the rate of PSA, the histology, the Gleason’s score, the assessment of extension, the various treatments and their results.
Results: twelve patients were included. The average was 51.8 ± 2.5 years.Three patients had a family antecedent of prostate cancer. The rate of average PSA was 557.3 with extremes of 2.5 and 5000 ng/ml. Eight patients presented a metastasis prostate cancer. One patient had been put under waiting watchful, 3 had a radical prostatectomy and 8 had hormone therapy. Four patients (25%) had died.
Conclusion: The prostate cancer at the subjects of less than 56 years has a bad prognostic in our practice. It requires an earlier diagnosis.
Keywords: Prostate, cancer, age, pronostic.
Introduction
Le cancer de la prostate est l’un des principaux problèmes de santé publique touchant la population masculine puisqu’il se situe au premier rang des cancers chez l’homme dans les pays développés, nettement devant les cancers du poumon et du colonrectum [1]. Son incidence est en forte augmentation en raison de l’effet combiné du vieillissement de la population, de l’amélioration de la sensibilité des techniques diagnostiques et de la diffusion du dosage du PSA [2]. Parallèlement, on observe une diminution de son taux de mortalité du fait de l’efficacité des traitements et de la précocité du diagnostic.Concernant le cancer de la prostatechez le sujet jeune (âge ≤ 55 ans),l’incidence a été plus importante que celle de tout autre groupe d’âge au cours des deux dernières décennies.Salinas et al. [3] rapportent plus de 10% de nouveaux cas aux USA ; Howlader et al. [4] notent que l’incidence du cancer de la prostate chez les jeunes hommes a été multipliée par 5,7 entre 1986 et 2008, passant de 5,6 à 32 cas pour 100 000 années-personnes. Cette évolution peut constituer une préoccupation particulièrement importante compte tenu des données existantes suggérant que la survie dans ce cancer varie selon l’âge au moment du diagnostic. Le cancer de la prostate de l’homme de moins de 56 ans ne semble pas présenter des caractéristiques différentes de celui de l’homme plus âgé [5]. Le jeune âge ne semble pas influencer les résultats carcinologiques des différents traitements. De plus, les études ayant analysé son pronostic dans cette population ont abouti à des résultats contradictoires. Certaines ont suggéré que le cancer de la prostate de l’homme jeune avait un meilleur pronostic que celui de l’homme âgé [6,7], alors que d’autres ont rapporté un pronostic défavorable [8,9]. L’attitude thérapeutique idéale face à ce cancer chez l’homme jeune reste donc à clarifier en fonction des facteurs pronostiques. Dans une étude sur 50302 hommes porteurs d’un cancer de la prostate à faible risque de D’AMICO, Mahal et al.[10] notent que les taux de surveillance active ont quadruplé pour les patients âgés de ≤ 55 ans entre 2010 et 2015, avec des résultats favorables à court terme. Cependant, les taux absolus de surveillance active chez les patients plus âgés (P < 0,001) sont encore plus élevés, ce qui suggère une certaine ambivalence nationale à l’égard de cette option thérapeutique chez les patients plus jeunes. En France, le dépistage individuel recommandé par l’Association française d’urologie permet de poser ce diagnostic de plus en plus précocement. Il en résulte un nombre croissant de cancers diagnostiqués avant l’âge de 50 ans, notamment dans les familles à risque, avec beaucoup de formes jugées à faible risque de progression. En Afrique, des études ont rapporté des cas de cancer de la prostate chez des sujets jeunes [11]. L’objectif de notre travail était d’étudier les aspects épidémiologiques, diagnostiques, thérapeutiques et pronostiques du cancer de la prostate chez les sujets de moins de 56 ans au Sénégal.
Patients et méthodes
Il s’agissait d’une étude prospective portant sur 12 patients âgés de moins de 56 ans, suivis pour cancer de la prostate au service d’urologie andrologie du centre hospitalier universitaire Aristide Le Dantec du 1er Janvier 2010 au 31 Décembre 2012 soit une période de trois ans. Les paramètres étudiésétaient l’âge, les facteurs de comorbidité (HTA, diabète, cardiopathies, insuffisance rénale, anémie), l’état général selon l’échelle Eastern Cooperative Oncology Group (ECOG) performans status [12], les antécédents familiaux de cancer de la prostate ou de cancer du sein, le toucher rectal, le taux de PSA total et sa cinétique, le type histologique, le score de Gleason, le bilan d’extension (tomodensitométrie, imagerie par résonnance magnétique), la classification de D’AMICO en cas de tumeur localisée, la classification TNM 2009 [13]. Selon le traitement instauré (surveillance active, prostatectomie radicale, castration) des paramètres supplementaires ont été étudiés, notamment les paramètres opératoires et péri opératoires : curage ganglionnaire (limité, standard, étendu), classification pathologique, Gleason post opératoire, classification TNM post opératoire,complications (fistule uro-génitale, incontinence urinaire, trouble de l’érection, sténose anastomotique) ; le traitement complémentaire (hormonothérapie, radiothérapie, biphosphonates), les complications de la castration (bouffée de chaleur, baisse de la libido, dysfonction érectile, gynécomastie). Les données ont été saisies et exploitées dans le tableur Excel 2007.
Résultats
Sur une période de 3 ans, 12 cancers de la prostate chez des sujets de moins de 56 ans ont été diagnostiqués et inclus parmi 279 cas de cancer de la prostate, soit 4,3 % des cas. L’âge moyen était de 51,8±2,5 ans. Onze patients avaient un âge compris entre 50 et 55 ans et un patient avait 48 ans. Trois patients avaient un antécédent familial (père ou frère) de cancer de la prostate. L’état général était conservé chez 6 patients (ECOG 0-2) et altéré chez les 6 autres (ECOG 3-4). Au toucher rectal, 3 patients avaient une prostate d’aspect normal tandis que 9 patients avaient une prostate suspecte de cancer dont 8 au stade clinique T2. Les facteurs de comorbidité notés chez 3 de nos patients étaient l’HTA, le diabète et la cardiopathie.La médiane du taux de PSA total était de 557,3ng/ml avec des extrêmes de 2,5 et 5000 ng/ml. Un patient avait un taux de PSA à 2,5 ng/ml. L’analyse histologique avait retrouvé un adénocarcinome chez tous les 12 patients. Les lésions ont été regroupées en tumeurs localisées, localement avancées et tumeurs métastasées. Huit patients (66,7%) avaient un cancer métastasé.Quatre patients avaient des métastases osseuses, 2 avaient des métastases pulmonaires et 2 avaient une location secondaire hépatique.Parmi les 4 cas de cancers localisés, un était à risque faible (PSA=4,1 ng /ml, Gleason 6, T2aN0M0) deux à risque intermédiaire (PSA=17,3 ng/ml, Gleason 6, T1cN0M0 et PSA=12,2 ng/ml, Gleason 6, T1cN0M0) e t u n à h aut r isque de D’AMICO (PSA=21,1 ng/ml, Gleason 6, T1cN0M0) (tableau I).
Tableau I: Données diagnostiques de 12 patients jeunes souffrant de cancer de la prostate au CHU Le Dantec au Sénégal.

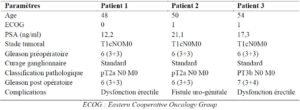
Au plan thérapeutique, une suppression androgénique chirurgicale et/ou chimique était réalisée chez 8 patients, une prostatectomie radicale chez 3 patients tandis que 1 était mis sous surveillance active. Le patient sous surveillance active était âgé de 55 ans. Il présentait un adénocarcinome localisé à risque faible de D’AMICO et ne présentait pas de facteur de comorbidité. Après 4 mois de suivi, l’évolution était stable (stade clinique T2a et PSA=4,24). Aucun critère de progression n’était noté. D’où la poursuite de la surveillance active. Dans notre série, l’indication de la prostatectomie radicale a été posée chez trois patients devant la présence d’un adénocarcinome prostatique localisé classé T1cN0M0. Il s’agissait de deux adénocarcinomes à risque intermédiaire et unà risque élevé de D’AMICO(tableau II). Après un recul moyen de 13 mois, la survie globale chez les patients ayant eu une prostatectomie radicale était de 100%.
Tableau II: Récapitulatif des données des patients qui ont subi une prostatectomie radicale
Dans notre série, la suppression androgénique avait été indiquée chez 8 patients pour cancer de la prostate métastasé (tableau III). La moyenne d’âge était de 53±2,1 ans. Six patients avaient eu une pulpectomie. Après trois mois d’hormonothérapie, nous avons noté une amélioration de l’état général chez 5 patients ; le taux de PSA avait régressé chez 7 patients avec une moyenne passant de 829,2 ng/ml à 37,3 ng/ml ; un patient était décédé avant les 3 mois. Le délai moyen d’apparition du nadir était de quatre mois. Après 18 mois d’hormonothérapie, 4 patients étaient décédés, 3 patients avaient un bon état général (ECOG 1) et un avait un mauvais état général (ECOG 4). Nous avons noté une survie sans progression chez 2 patients et quatre patients avaient un taux de PSA supérieur ou égal à 100 ng/ml. Nous avons observé une absence de réponse au traitement hormonal chez 3 patients (patients 2, 4 et 7 du tableau III). Le temps moyen de survenue du décès chez ces 3 patients était de 220 jours.
Tableau III: Récapitulatif des données des patients qui ont subi une castration

Les quatre patients décédés avaient une altération initiale de l’état général. Ils avaient tous une tumeur métastasée. Parmi eux, 2 avaient un Gleason 8 et 3, un antécédent familial de cancer de la prostate.
Discussion
L’incidence du cancer de la prostate ajustée sur l’âge a considérablement augmenté à la fin des années 1980 et au début des années 1990, à la suite dudépistage avec le PSA sérique. Environ 10% des 241 740 hommes chez lesquels un cancer de la prostate a été diagnostiqué en 2012 représentent le cancer de la prostate à début précoce défini dans le présent document comme étant des hommes diagnostiqués à l’âge de 55 ans ou moins [3]. Quasi nulle entre 1980 et 2000 chez les hommes de moins de 55 ans [14], elle est estimée à 402 en 2011 dans la tranche d’âge de 15-49 ans en France [15]. Les statistiques nordaméricaines rapportent une incidence annuelle de 21/100000 hommes avant 65 ans et la probabilité d’être atteint d’un cancer de la prostate passe de 1/10000 hommes de moins de 39 ans à 1/103 entre 40 et 59 ans [16]. Au Sénégal, dans une étude sur la détection précoce du cancer de la prostate par le toucher rectal et le dosage de PSA, Niang et al. n’avaient diagnostiqué aucun cas avant 50 ans en deux ans [17] alors que nous avons eu une moyenne de 4 cancers de la prostate par an, avec une augmentation croissante de 2 à 7 cancers de la première à la troisième année. L’incidence croissante du cancer de la prostate avant 56 ans est suffisamment importante pour préconiser le dépistage précoce plus tôt que les recommandations actuelles [18].
Les facteurs de risque du cancer de la prostate actuellement identifiés avec certitude sont l’âge, l’existence d’antécédents familiaux de cancer de la la prostate ou du sein et l’origine ethnique mélanoderme [3,19]. Par ailleurs, dans une population d’hommes afro-américains ayant subi une prostatectomie radicale, Weprin et al. [20].ont observé une association indépendante d’un faible statut socio-économique avec un cancer de la prostate au stade avancé ou agressif. Ces facteurs de risque sont identiques chez le sujet de moins de 50 ans [5].
En effet, les cancers de la prostate familiaux surviennent en moyenne cinq à dix ans plus tôt que dans la population générale [21] et ils débutent également plusprécocement chez les mélanodermes [22]. Cela est conforme à notre série où les 3 patients qui avaient un antécédent familial de cancer de la prostate étaient les moins âgés. Si un antécédent familial de cancer de la prostate n’est identifié habituellement que chez 15% des patients présentant un cancer de la prostate, la proportion est d’environ 40% chez les patients ayant un cancer de la prostate de survenue précoceavant 55 ans [21]. Dans une étude multicentrique française portant sur 5880 patients traités pour un cancer de la prostate entre 1994 et 2004, seulement 1,9% d’entre eux avaient 50 ans ou moinset 47,3% avaient une agrégation familiale de ce cancer [8]. Nous avons noté l’existence d’antécédent familial (père, frère) de cancer de la prostate chez 3 patients sur 12 (25%).
Nos résultats sont conformes aux données de la littérature et confirment la prédominance des formes familiales chez les sujets moins âgés. Cliniquement, l’altération de l’état général était constatée chez 50 % de nos patients. BOTTO et al. [23] ainsi que RIGAUD et al. [24] en France, ont rapporté respectivement 47,5% et 30% d’altération de l’état général. Cette différence est certainement due au fait que les patients consultent tardivement dans nos pays africains. Les facteurs de comorbidité étaient retrouvés chez 41,7 % de nos patients. Cela est conforme aux données de JACKSON et al. [25] qui avaient identifié 40% de facteurs de comorbidité chez les noirs américains.
Dans notre étude, neuf patients présentaient des lésions prostatiques suspectes de cancer. Dans ce lot, huit patients avaient un stade clinique T2 (dont 2 cas de cancer de la prostate familiaux et 6 sporadiques) et un avait un stade clinique T4. Il n’y avait pas de différence clinique entre les cas familiaux et sporadiques. Aux Etats-Unis, SMITH e t a l. [ 6] avaient rapporté 59,5 % des cas au stade clinique T2 dans une population de moins de 50 ans.
Dans notre série, le taux de PSA moyen était égal à 557,3 ng/ml et 8 patients étaient au stade métastatique. Cette moyenne était supérieure à celle de FALL et al. [26] (101 n g/ml) qui ne traitaient pourtant que de cancers métastasés. Même si elle était moins importante (60,4 ng/ml) lorsqu’on isolait les 2 cas qui avaient un taux de PSA à 5000 et 1084 ng/ml, ce taux élevé dans notre étude témoigne probablement de l’agressivité biologique de ce cancer chez les sujets moins âgés. En Asie, Hong et al. [9] avaient noté un score de Gleason supérieur ou égal à 8 chez 12,7% des patients de moins de 60 ans. Après une analyse multivariée, ils avaient conclu que le cancer de la prostate était plus agressif chez ces patients plus jeunes en comparaison à ceux qui avaient plus de 60 ans. Dans notre courte série, nous avons noté 25 % de tumeurs dont le score de Gleason était supérieur à 7. Nous n’avons pas noté de différence entre les cancers familiaux et les sporadiques. Cette proportion plus élevée de cancers peu différenciés témoigne de l’agressivité du cancer de la prostate chez nos patients car le score de Gleason est un important facteur pronostique.
Sur le plan thérapeutique, l’intérêt de la surveillance active chez un nombre croissant de patients en alternative au traitement curatif immédiat est aujourd’hui démontré.Elle reste donc une option thérapeutique. La prise en charge des hommes âgés de ≤ 55 ans atteints d’un cancer de la prostate à faible risque est discutée étant donné les répercussions sur la qualité de vie d’un traitement définitif par rapport à l’opportunité manquée potentielle de guérison par une gestion prudente. Dans une étude sur la gestion conservatrice chez les patients plus jeunes atteints du cancer de la prostate, Mahal et al. [10] rapportent que le taux d’utilisation de la surveillance active a quadruplé pour les patients âgés de ≤ 55 ans entre 2010 et 2015 (8,61% en 2010 à 34,56% en 2015 chez les hommes âgés de ≤ 55 ans et de 15,99% à 43,81% chez les hommes âgés de ≥ 56 ans) avec des résultats favorables à court terme. Ces résultats démontrent l’innocuité à court terme et l’acceptation croissante de la surveillance active chez les patients plus jeunes et plus âgés. Cependant, les taux absolus de surveillance active chez les patients plus âgés (P < 0,001) sont encore plus élevés, ce qui suggère une certaine ambivalence nationale à l’égard de cette option thérapeutique chez les patients plus jeunes.Un seul de nos patients (8,33%) ayant un adénocarcinome localisé à risque faible avait été mis sous surveillance active. Après 4 mois de suivi, le patient ne présentait pas de critères de progression. Il était toujours sous surveillance. Malgré le faible effectif et le faible recul, nos résultats confirment les données de la littérature.
Actuellement, le cancer de la prostate est majoritairement découvert à un stade localisé dans les pays occidentaux [27]. Les traitements locaux, avec au premier rang la prostatectomie radicale, permettent de guérir la majorité de ces cancers sans traitement complémentaire. Dans notre série, 3 patients avaient eu une prostatectomie radicale. Après un recul moyen de treize mois, la survie sans progression avait été observée chez un patient, deux patients avaient nécessité une hormonothérapie néoadjuvante qui avait amélioré les paramètres biologiques. Par ailleurs, deux patients (66,7 %) avaient présenté des troubles érectiles. Rose Dite Modestine et al. [28], qui ont analysé une série de 2088 patients classés à risque faible, intermédiaire et haut selon D’AMICO respectivement dans 13,2%, 80,8% et 6% traités par prostatectomie totale en 12 ans (entre 2007 et 2019) rapportent une augmentation de fréquence du traitement chirurgical radical des cancers de haut risque et une diminution des prostatectomies en cas de cancer à faible risque. Les indications de prostatectomie totaleet de curage ganglionnaire ont évolué en adéquation avec les recommandations de bonnes pratiques cliniques prises en considération en réunion de concertation pluridisciplinaire d’oncourologie. Nos indications sont conformes ces recommandations de bonnes pratiques cliniques. Selon Salinas et al. [3], plusieurs études cliniques ne signalent aucune différence significative de survie entre les groupes d’âge ou un meilleur pronostic chez les plus jeunes hommes après prostatectomie radicale curie-thérapie ou radiothérapie. Cependant, d’autres études, basées sur un registre du cancer ou d’autres données, indiquent une survie systématiquement inférieure chez les patients les plus jeunes, pire que pour tous les autres groupes d’âge sauf les hommes diagnostiqués à plus de 80 ans. Lin et al. [29] ayant examiné 318 774 hommes diagnostiqués entre 35 et 74 ans entre 1988 et 2003 à partir des données des registres du cancer aux Etats-Unis ont constaté que les hommes diagnostiqués à moins de 55 ans étaient plus susceptibles d’avoir un cancer de grade inférieur. À l’inverse, parmi les hommes atteints d’un cancer de grade Gleason élevé ou localement avancé au diagnostic, les hommes plus jeunes avaient un pronostic particulièrement mauvais.
La castration entraîne une diminution considérable des manifestations cliniques. Ainsi, nous avons noté une amélioration de l’état général chez 5 patients sur huit (chez 4 sur les 6 qui avaient eu la pulpectomie) en trois mois. Dans l’étude de Botto et al. [23], tous les patients avaient une amélioration de l’état général, des troubles urinaires et des douleurs osseuses en un an. Après traitement hormonal, le PSA baisse à un taux variable en trois à six mois, le taux le plus bas observé ayant une valeur pronostique sur la survie sans récidive. L’abaissement du PSA est observé pendant une durée moyenne de 18 à 24 mois, puis survient une ré-augmentation du taux [30]. Les données de Fall et al. [26] qui notaient une diminution de 75% des taux de PSA à 3 mois et un délai moyen d’obtention du nadir de 6 mois sont superposables aux nôtres où nous avons observé une régression de 87 % des taux PSA total à 3 mois avec un délai moyen d’obtention du nadir du PSA de 4 mois. Dans notre étude, le temps moyen de survie était de 9,5 mois tandis que Botto et al. en France [23] montrent un temps médian de survie de 33 mois. Cette différence est certainement liée à la période moins longue de notre étude. Elle pourrait aussi confirmer l’agressivité du cancer de la prostate chez les sujets jeunes et les hommes de race noire.
Les bouffées de chaleur, le syndrome métabolique, la diminution de la libido, la dysfonction érectile, l’anémie, la gynécomastie, les dysfonctions cognitives, la diminution de la masse musculaire et l’ostéoporose sont les effets secondaires les plus fréquents de la castration [31]. Dans notre série, la majorité de ces effets secondaires étaient présents dans l es mêmes p roportions que FALL et al. [26]. Quatre de nos patients sous traitement hormonal sont décédés. Une évolution rapide avait été notée dans 1 cas, le décès étant survenu après 1 mois. Au regard des caractéristiques clinico-biologiques (ECOG=3, PSA =2,5 ng/ml) et de l’évolution rapide chez ce patient, une analyse immuno-histochimique à la recherche d’une composante neuroendocrine aurait été utile. En effet, devant un cancer de la prostate, plusieurs éléments doivent faire évoquer un cancer neuroendocrine tant sur le plan clinique, paraclinique qu’anatomopathologique. Parmi les éléments cliniques, l’existence d’une altération de l’état général d’installation et d’évolution rapides ainsi que la présence de douleurs abdominales paroxystiques sont fortement évocatrices d’une forme neuroendocrine. Sur le plan biologique, un faible taux de PSA discordant avec le toucher rectal et/ou le stade clinique (M+) doit également attirer l’attention [32]. Le carcinome neuroendocrine de la prostate est une entité rare, qui regagne de l’intérêt actuellement dans la pathologie prostatique. Son origine est discutée [33]. Son diagnostic est histologique. Sa fréquence est sous-estimée puisque son dépistage n’est pas fait de manière systématique. Une différentiation neuro-endocrine est présente dans presque la moitié des adénocarcinomes classiques de la prostate lorsqu’on la recherche par immuno-histochimie avec plusieurs marqueurs neuroendocrines dont la Chromogranine A et le NSE (NeuronSpecificEnolase) [26]. C’est une tumeur rapidement évolutive dont le pronostic demeure sombre [33].
Certains facteurs ont été associés à la diminution significative de la survie globale: index ECOG élevé, mode de révélation du cancer par altération de l’état général ou les douleurs osseuses, score de Gleason> 5, présence de métastase osseuse [23,24]. Cela concorde avec notre série où l’altération initiale de l’état général et la mauvaise différenciation tumorale sont corrélées aux décès.
Après dix mois de suivi moyen dans notre série, l’ECOG moyen est passé de 2,5 à 2,6. Le PSA Nadir moyen était de 50,4 ng/ml avec un délai d’apparition moyen de 4 mois. La survie globale était de 66,7% (8 patients). En dépit de la petite taille de notre échantillon, la prédominance des tumeurs métastasées (8 sur 12), la proportion des patients dont le score de Gleason était supérieur à 7 (3 sur 12) et la mortalité globale (4 décédés sur 12 patients) confirment l’agressivité du cancer de la prostate qui est grevé d’une mauvaise survie chez les sujets jeunes.Ce constat est partagé par HONG [9] qui avait noté, dans les cancers à haut risque, une plus mauvaise survie sans progression biochimique chez les patients de moins de 60 ans.
Conclusion
Le cancer de prostate est devenu, par sa fréquence et la mortalité qui lui est associée, un problème de santé publique. Celui de l’homme jeune ne semble pas présenter des caractéristiques différentes de celui de l’homme plus âgé. Le jeune âge ne semble pas influencer les résultats carcinologiques des différents traitements. En dépit de la taille réduite de notre échantillon, la prédominance des tumeurs métastasées, la proportion des patients ayant une mauvaise différenciation tumorale et la mortalité globale semblent confirmer l’agressivité du cancer de la prostate qui est grevé d’une mauvaise survie chez les sujets jeunes dans notre contexte. Des travaux sur des échantillons plus larges, multicentriques au Sénégal et même dans d’autres pays d’Afrique devraient être nécessaires pour tirer de meilleures conclusions. Aussi, la présence de formes familiales de cancer de la prostate et la race noire doivent nous inciter à rechercher ce cancer dès l’âge de 45 ans.
Contribution des auteurs
Mougougou A : auteur principal, recherche bibliographique ; Massandé Mouyendi J et Ndang Ngou Milama : lecture, corrections ; Diao B : encadrement scientifique
Références
2. HAS/ Service des maladies chroniques et dispositifs d’accompagnement des malades. INCa/ Département des recommandations pour les professionnels de santé. Guide ALD n° 30 : Cancer de la prostate. Révision Janvier 2012.
3. Salinas CA, Tsodikov A, Ishak-Howard, et al. Prostate Cancer in Young Men: An Important Clinical Entity. Nat Rev Urol 2014; 11(6): 317-23.
4. Howlader NNA, Krapcho M, Neyman N, et al., editors. SEER Cancer Statistics Review, 1975–2009. 2012 (Vintage 2009 Populations), based on November 2011 SEER d ata s ubmission, p osted to the SEER web site, April 2012. [serial online] Available from URL: http://seer.cancer.gov/csr/1975_2009_pops0 9/</csr/1975_2009_pops09/
5. Peyromaure M, Valeri A, Rebillard X, et al. Spécificités du cancer de la prostate avant l’âge de 50 ans. Prog Urol 2009;19:803-09.
6. Smith CV, Bauer J J, C onnelly R R, e t a l. Prostate cancer in men age 50 years or younger: a review of the department of defense center for prostate disease research multicenter prostate cancer database. J Urol 2000;164:1964-67.
7. Twiss C, S lova D , Lepor H . O utcomes for men younger than 50 years undergoing radical prostatectomy. Urol 2005;66:141-46.
8. Siddiqui SA, Sengupta S, Slezak JM, et al. Impact of patient age at treatment on outcome following radical retropubis prostatectomy for prostate cancer. J Urol 2006;175:952-57.
9. Hong SK, Nam JS, Na W, et al. Younger patients have poorer biochemical outcome after radical prostatectomy in high-risk prostate cancer. A J Androl 2011;13:719-23.
10. Mahal AR, Butler S, Franco I, et al. Conservative management of lowrisk prostate cancer among young versus older men in the United States: Trends and outcomes from a novel national database. Cancer. 2019. Doi.org/10.1002/cncr.32332.
11. Sarr A , S ow Y, T hiam I , e t a l. D étection précoce du cancer de la prostate chez le quadragénaire au Sénégal. Prog Urol 2011;21:260-63.
12. Oken M, Creech R, Tormey D, et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol. 1982;5:649-55.
13. Rozet F, Hennequin C, Beauval JB, et al. Recommandations en onco-urologie 2016- 2018 du CCAFU : Cancer de la prostate. Prog Urol 2016;27 (S1) : 95-143.
14. Grosclaude P, Davin JL, Neuzillet Y, et al. Evolution de l’épidémiologie du cancer de la prostate depuis 20 ans. Prog Urol 2006;16:653-60.
15. Projection de l’incidence et de la mortalité par cancer en France en 2011. Rapport technique. Saint-Maurice : institut de veille sanitaire ; 2011. 78p
16. Valeri A, Joulin V, Moineau M, et al. Three- Year Prostate Cancer Screening Program In High Risk Families: High Detection Associated With The Number Of Affected Relatives And Early Onset. Eur Urol 2004;2(3):100.
17. Niang L, Kouka C, Jalloh M, et al. Screening for prostate cancer by digital rectal examination and PSA determination in Senegal. ISRN Oncology 2011;2011:ID 943704, 4p.
19. Fournier G, Valeri A, Mangin P, et al. Cancer de la prostate. Epidémiologie. Facteurs de risque. Anatomopathologie. An Urol 2004;38:187-206.
20. Weprin SA, Parker DC, Jones JD, et al. Association of low socioeconomic status with adverse prostate cancer pathology among african american men who underwent radical prostatectomy. Clin Genitourin Cancer. 2019. doi.org/10.1016/j.clgc.2019.06.006.
21. Cussenot O, Valeri A, Fournier G. Formes familiales des cancers de la prostate. Concours Med 2005;127:1257-62.
22. Brawley O W, K nopf K , Merrill R . T he epidemiology of prostate cancer part I: descriptive epidemiology. Semin Urol Oncol 1998;16:187-92.
23. Botto H, Roupret M, Mathieu F, et al. Etude randomisée multicentrique comparant la castration médicale par triptoréline à la castration chirurgicale dans le traitement du cancer de la prostate localement avancé ou métastatique. Prog Urol 2007;17:235-39.
24. Rigaud J , Normand L E, K aram G , e t a l. Facteurs pronostiques du cancer de la prostate traité par hormonothérapie de première intention Prog Urol 2002;12:232-39.
25. Jackson EF, Steven AB, Gail B, et al. Race and cause specific survival with prostate cancer: influence of clinical stage, Gleason score, age and treatment. J Urol 2000;163:137-42.
26. Fall B, Tengue K, Sow Y, et al. Place de la pulpectomie bilatérale dans la suppression androgénique pour cancer de la prostate. Prog Urol 2012;22:344-49.
27. Long JA, Thuillier C, Terrier N, et al. Place de la prostatectomie radicale dans le traitement du cancer de prostate. Méd Nucl 2011;35:384-89.
28. Rose dite Modestine J, Neuzillet Y, Herve JM, et al. Evolution sur 12 ans des indications de prostatectomie totale pour cancer. Prog Urol 2019 ;29(8-9) :408-15.
29. Lin DW, Porter M, Montgomery B. Résultats du traitement et de la survie chez les jeunes hommes atteints d’un cancer de la prostate: une étude de cohorte basée sur la population. Cancer 2009; 115 : 2863-71.
30. Fegoun ABE, Villers A, Moreau JL, et al. PSA et suivi après traitement du cancer de la Prostate. Prog Urol 2008;18:137-44.
31. Lebret T, Mejean A. Gestion des effets secondaires de la suppression androgénique. Prog Urol 2008;7:338-42.
32. Helpap B, Kloppel G. Neuroendocrine carcinomas of the prostate and urinary bladder: a diagnostic and therapeutic challenge. Virchows Arch 2002;440:241-48.
33. Breton X, Plazanet C, Murat FJ, et al. Cancer neuroendocrine de la prostate. A propos de 6 cas. Prog Urol 2003;13:1340-44.