Nyangui Mapaga J, Camara IA, Diouf Mbourou N, Nsounda Mandzela A, Gnigone PM, Mambila Matsalou GA, Moubeka Mouguengui M, Mouangue G, Kouna Ndouongo Ph
Service de Neurologie du Centre Hospitalier Universitaire de Libreville (CHUL)
Correspondant : Nyangui Mapaga Jennifer ; Email:jenica45@yahoo.fr
Résumé
Introduction : L’encéphalopathie postérieure réversible est une pathologie rare, peu connue et reste probablement sous diagnostiquée. Les étiologies et les facteurs favorisants sa survenue sont nombreux. Le postpartum est de loin le facteur favorisant rencontré. Le contexte clinique évocateur, ainsi que le caractère rapidement réversible des anomalies cliniques et radiologiques font évoquer le diagnostic.
Objectif : Décrire deux cas d’encéphalopathie postérieure réversible découverts dans la période du post-partum.
Matériel et méthodes : cette étude prospective à visée descriptive réalisée dans le service de neurologie du CHUL rapporte les dossiers de deux patientes âgées de 28 ans et 32 ans qui ont été hospitalisées pour des crises convulsives tonicocloniques généralisées, précédées de céphalées, qui étaient en post-partum et dont l’imagerie a mis en évidence des lésions bilatérales postérieures au niveau des hémisphères cérébraux. La réversibilité du tableau clinique et aussi radiologique nous a permis de conclure à l’encéphalopathie postérieure réversible.
Résultats et conclusion : Il en ressort que l’encéphalopathie postérieure réversible présente un polymorphisme clinique et radiologique pouvant sous – estimé cette affection et le post-partum est de loin le facteur favorisant le plus impliqué.
Mots clés : encéphalopathie postérieure réversible, post-partum, céphalées, hypertension artérielle
Introduction
L’encéphalopathie postérieure réversible (PRES) est un syndrome neurologique aigu ou subaigu réversible [1-3]. Il s’agit d’une pathologie rare dont le diagnostic est radioclinique [4,5]. Décrit pour la première fois par Hinchey en 1996 dans le New England Journal of Medicine qui lui attribue le nom de leucoencéphalopathie postérieure réversible [3], l’encéphalopathie postérieure réversible, présente diverses origines pathologiques, telles que l’hypertension artérielle sévère, la pré-éclampsie, l’éclampsie, la transplantation d’organes et de moelle osseuse, la dysfonction rénale, l’auto-immunité, la septicémie et la chimiothérapie [6]. Bien que la physiopathologie ne soit pas claire, les mêmes mécanismes pathogènes sont partagés [6]. Ce syndrome est caractérisé par des céphalées, les troubles du comportement, les convulsions, des troubles visuels et des déficits neurologiques focaux. La neuro-imagerie est importante pour le diagnostic. La tomodensitométrie (TDM) ou l’imagerie par résonance magnétique (IRM) révèlent un oedème diffus plus important dans les lobes pariétal et occipital bilatéralement [7]. L’élimination de l’étiologie sous-jacente et la régulation de la pression artérielle sont les premières mesures dans le PRES mais la nature réversible du PRES a été contestée récemment sur la base de nouveaux rapports d’atteinte neurologique permanente et de mortalité atteignant 15%[8].Ce syndrome, bien intégré des neurologues et des neuroradiologues, reste encore méconnu des cliniciens [9]. Nous rapportons ainsi deux cas de PRES chez les patientes en post-partum.
Observation 1
Nous rapportons le cas d’une patiente âgée de 28 ans, droitière, deuxième geste, sans antécédent particulier, qui a présenté à J10 d’un accouchement par césarienne à la 37ème semaine d’aménorrhée (SA), des céphalées en casques atroces, associées à des vomissements et des crises convulsives tonicocloniques généralisées avec morsure latérale de la langue et perte d’urines. Amenée au service des Urgences, la patiente présentait une pression artérielle élevée à 230/120 mmHg. L’examen neurologique a retrouvé une patiente obnubilée avec un score de Glasgow à 13/15, une nuque souple, les réflexes ostéotendineux normaux, les réflexes cutanés plantaires en flexion. Aussi la protéinurie était négative. Aucun déficit sensitivomoteur n’a été mis en évidence. Le scanner cérébral sans injection avait mis en évidence des hypodensités pariétooccipitales bilatérales associées à des hyperdensités des sillons corticaux du lobe pariétal droit (figure 1).

Figure 1 : TDM cérébrale montrant des hypodensités bilatérales parietooccipitale associées à une hyperdensité au niveau des sillons corticaux pariétaux droit
Elle a bénéficié d’un protocole à base d’antihypertenseur avant d’être transférée dans le service de Neurologie pour complément de prise en charge. Nous avons évoqué devant ce tableau une encéphalopathie postérieure réversible et une thrombose veineuse cérébrale. L’angioscanner avec temps veineux et le dosage des D-dimère négatif a permis d’éliminer une thrombose veineuse cérébrale. L’EEG a objectivé une souffrance cérébrale diffuse avec des anomalies épileptiques. Le reste du bilan infectieux (NFS, sérologies virale et syphilitique), inflammatoire (VS, CRP), immunologique) était normal. Elle a reçu un traitement à base d’antihypertenseur et d’antiépileptique soit phénobarbital 100mg, 1 comprimé le soir. Une IRM cérébrale était normale trois semaines plus tard nous permettant de conclure à une encéphalopathie postérieure réversible.
Observation 2
Il s’agit d’une patiente de 32 ans, sans antécédents pathologiques notables, primipare avec une grossesse correctement suivie de 38 semaines d’aménorrhée. Elle a présenté au cours de l’accouchement un pic hypertensif à 220/130 mmHg. A J1 du post-partum, la patiente a présenté des céphalées suivies d’un état de mal convulsif évoluant dans un contexte non fébrile. La protéinurie était négative. La patiente, admise en service de réanimation, a reçu du sulfate de magnésium puis a été transférée deux jours plus tard dans le service de neurologie. L’examen neurologique retrouvait une patiente en bon état général avec une tension artérielle à 120/80 mmHg, sans déficit sensitivomoteur. Les réflexes ostéotendineux étaient vifs aux quatre membres. L’EEG objectivait une souffrance cérébrale diffuse avec présences de graphoéléments (figure 2).
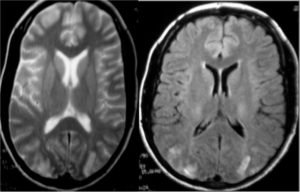
Figure 2 : IRM cérébrale montrant un hypersignal en parieto-occipitla en séquence T2 et Flair
L’IRM cérébrale était en faveur d’une leucopathie postérieure réversible. La patiente a été mise sous phénobarbital à la posologie de 100 mg par jour. Elle est sortie de l’hôpital et aucune récidive n’a été observée.
Discussion
Le terme PRES a été utilisé sur la base de la similitude dans l’apparence sur l’imagerie, la localisation commune du lobe pariéto-occipital ou la localisation «postérieure» des lésions [8]. La première description clinique faite par Hinchey et al en 1996, était en termes de leucoencéphalopathie postérieure réversible, et reprise par Casey qui proposa la dénomination de « Posterior Reversible Encephalopathy Syndrome » (PRES) en raison de l’atteinte retrouvée au niveau de la substance grise [4]. Les facteurs favorisants reconnus et rapportés dans la littérature sont l’hypertension artérielle, la toxémie gravidique, l’insuffisance rénale, les traitements immunosuppresseurs et anticancéreux [3,9]. Le PRES associé aux cas de transfusionsanguine est aussi rapporté dans la littérature [8]. La physiopathologie du PRES n’est pas complètement élucidée à ce jour. Cependant, deux grandes théories sont évoquées. La première est la théorie de l’hyper perfusion cérébrale : une élévation transitoire de la pression artérielle est classiquement retrouvée avec une hyperperfusion cérébrale par dépassement des mécanismes d’autorégulation du débit sanguin cérébral, expliquant l’oedème cérébral vasogénique, d’où les manifestations neurologiques d’évolution rapidement favorables dès la maitrise de la pression artérielle. La deuxième théorie est celle de l’hypoperfusion cérébrale reflexe (vasoconstriction, spasme, ischémie) à l’occasion d’un processus systémique (infection, transplantation, chimiothérapie anticancéreuse…). Il s’en suit une activation du système immunitaire et un dysfonctionnement endothélial avec hyperperméabilité vasculaire d’où l’installation de l’oedème vasogénique [2,11]. D’autres auteurs évoquent trois théories vasoconstriction cérébrale entraînant des infarctus du cerveau, échec de l’autorégulation cérébrale avec oedème vasogénique, et lésions endothéliales avec perturbation de la barrière hémato-encéphalique conduisant à des fluides et transsudation de protéine dans le cerveau [8]. La majorité des cas répertoriés en obstétrique sont secondaires soit à une encéphalopathie hypertensive, à une pré-éclampsie, à une éclampsie ou à un HELLP syndrome [12]. Les deux théories expliquant la physiopathologie du PRES sont à l’origine des manifestations cliniques et radiologiques du PRES syndrome [2]. La clinique comprend les céphalées, les troubles de la vigilance et du comportement, les convulsions, les vomissements, la confusion mentale, le mutisme, les troubles de la perception visuelle. Les convulsions sont rapportées dans la littérature jusqu’à 92% des cas et les céphalées dans 26 à 53% justifiant la présentation clinique rencontré dans nos observations [13]. Pradhan retrouve des réflexes ostéotendineux vifs dans le PRES [14]. La topographie préférentielle du syndrome d’encéphalopathie postérieure réversible se situe au niveau de la substance blanche sous corticale des régions postérieures (pariéto-occipitales) des hémisphères cérébraux dans 98% des cas. La prédominance postérieure de l’atteinte est expliquée par le système d’autorégulation moins développé dans les territoires dépendant du système vertébrobasilaire et des artères cérébrales postérieures. En dépit d’être appelé postérieur, les lésions peuvent avoir une distribution non postérieure notamment les lobes frontaux (68 %), les lobes temporaux (40%) et les hémisphères cérébelleux (30%) [12]. L’atteinte unilatérale est possible de même que des lésions au niveau de la substance blanche profonde (capsule interne, externe, centre semi-ovale, corps calleux), des noyaux gris centraux et l’atteinte du tronc cérébrale [8,12]. L’imagerie encéphalique, notamment l’IRM, est l’élément clé du diagnostic. En effet, elle permet de montrer des anomalies de signal cortico-souscorticales pariéto-occipitales, hypodenses en T1, hyperdenses en T2 et en séquences FLAIR, avec cependant des séquences de diffusion normale. L’augmentation du coefficient apparent de diffusion (ADC) et la régression rapide des lésions (dans les 15 jours pour la plupart des cas) traduisent le caractère oedémateux vasogénique des lésions affirmant le diagnostic [21]. Chez la deuxième patiente, l’IRM cérébrale a mis en évidence des lésions hypodenses en séquence T1 et hyperdense en séquence T2 et Flair au niveau pariéto-occipitale, nous permettant avec le contexte clinique, de retenir le diagnostic d’encéphalopathie postérieure réversible. Dans le cas 1 un scanner cérébral a été réalisé en urgence mettant en évidence des hypodensités parieto-occipitales bilatérales, associées à une hyperdensité dans les sillons corticaux au niveau du lobe pariétal droit en faveur d’une hémorragie sous arachnoïdienne sulcale. La littérature rapporte que la TDM cérébrale est un moyen de diagnostic mais moins sensible. Elle peut être normale ou montrer des lésions hypodenses cortico sous corticales comme observées chez notre patiente ; des présentations atypiques comme la présence d’hémorragie sont possibles (cas 1). Trois types d’hémorragie peuvent se voir dans 5 à 30 % des cas selon les études avec une incidence similaire : hémorragie focale, hémorragie intraparenchymenteuse et hémorragie sous arachnoïdienne sulcale [13]. Dans notre cas (cas1), une hémorragie sous arachnoïdienne sulcale était associée. Le diagnostic et le traitement adapté et rapide du PRES permettent de prévenir l’apparition de lésions neurologiques irréversibles et de séquelles permanentes [15]. Sa prise en charge dépend de l’étiologie et du tableau clinique. La prise en charge a consisté à la mise sous antihypertenseur. En effet, les études rapportent que le contrôle de l’HTA est le volet primordial du traitement avec pour objectif de maintenir une pression artérielle moyenne entre 105 et 125 mmHg sans réduire cette pression de plus de 25% durant la première heure [6]. Un traitement antiépileptique a été instauré pour prévenir la survenue de crises ultérieures. Nous avons assisté à une régression notamment des céphalées et des crises convulsives. Certains auteurs rapportent que dans 90% des cas, les manifestations neurologiques régressent dès le 7ème jour de traitement antihypertenseur et/ou étiologique [6]. L’imagerie de contrôle notamment l’IRM cérébrale réalisée 3 semaines plus tard était normale (cas1). Une amélioration au niveau des images IRM est de règle en 15 jours mais une normalisation n’est parfois obtenue qu’au-delà d’une année [16]. Selon les études, le diagnostic et le traitement tardif peuvent entraîner une mortalité ou un déficit neurologique irréversible. La récidive est rapportée dans 3,8% des cas dans une série récente et pour une autre jusqu’à 15% des cas sont mortels [12,17]. Des marqueurs biologiques de mauvais pronostiques ont été identifiés dans la littérature : c’est le cas de la créatinine et la lactate déshydrogénase (LDH) ; leur élévation indique un pronostic plus sombre. En outre, la LDH est considérée comme un marqueur biochimique précoce du PRES, prédisant le degré d’oedème cérébral dans l’éclampsie et chez les patients cancéreux recevant une chimiothérapie. En plus des marqueurs biochimiques, la présente d’hémorragie et de diffusion restreinte sur la cartographie de l’ADC, suggérant un oedème cytotoxique par opposition à l’oedème vasogénique, sont également corrélés avec un pronostic plus sombre [18].
Conclusion
L’encéphalopathie postérieure réversible (EPR) est une maladie rare mais sévère du système nerveux central. Contrairement à son nom, il n’est pas toujours réversible. Un diagnostic rapide et une gestion agressive des causes sous-jacentes facilitent la réversibilité du PRES. Son contexte de survenue et son mode d’expression sont caractérisés par un grand polymorphisme clinique, rendant le diagnostic parfois difficile. L’imagerie tomodensitométrique et/ou par résonance magnétique est souvent caractéristique, ce qui permet de poser le diagnostic dans un contexte clinique évocateur. Certains aspects moins typiques doivent cependant être considérés afin de ne pas méconnaître cette affection dont l’évolution est conditionnée par la précocité du traitement.
Références
2. Bartynski WS. Posterior Reversible Encephalopathy Syndrome, Part 1: Fundamental Imaging and Clinical Features, AJNR Am J Neuroradiol 2008;29:1036–40.
3. Hinchey J, Chaves C, Appignani B et al. A reversible posterior leukoencephalopathy syndrome. N Engl J Med 1996 (334):494-500.
4. Casey SO, Sampaio RC, Michel E, et al. Posterior reversible encephalopathy syndrome: utility of fluid-attenuated inversion recovery mr imaging in the detection of cortical and subcortical lesions. Am J Neuroradiol 2000;21:1199-206.
5. Garg RK. Posterior leukoencephalopathy syndrome. Postgrad Med J 2001;77:24-8.
6. Xiao-Bo F, Dun-Jin C, Fang H, et al. Predictors of oedema type in reversible posterior leukoencephalopathy syndrome with preeclampsia or eclampsia. Pregnancy Hypertension 2018;11: 71-6.
7. Gungor S, Kilic B, Tabel Y, et al. Clinical and Imaging Findings in Childhood Posterior Reversible Encephalopathy Syndrome. Iran J Child Neurol 2018;12(1):16–25.
8. Sudulagunta SR, Sodalagunta MB, Kumbhat M, et al. Posterior reversible encephalopathy syndrome (PRES). Oxford Medical Case Reports 2017; 4:43-6.
9. Pinedo DM, Shah-Khan F, Shah PC. Reversible posterior leukoencephalopathy syndrome associated with oxaliplatin. J Clin Oncol 2007;25(33):5320-1.
10. Cozzolino. M, Bianchi C, Mariani G, et al. Therapy and differential diagnosis of posterior reversible encephalopathy syndrome (PRES) during pregnancy and postpartum.Arch Gynecol obstet 2015;292(6):1217-2.
12. Bembalgi S, Kamate V, Shruthi KR. A Study of Eclampsia Cases Associated with Posterior Reversible Encephalopathy Syndrome. J Clin Diagn Res 2015;9(7):5-7.
13. Lee VH, Wijdicks EF, Manno EM, et al. Clinical spectrum of reversible posterior leukoencephalopathy syndrome Arch Neurol 2008; 65:205-10.
14. Pradhan A, Jairam A, Kumar RS, et al. Posterior reversible encephalopathy syndrome post transplantation: a case report of possible association with cerebrospinal fluid leak after epidural catheterization. Transplant Proc 2009;41(5):1957-60.
15. Mohebbi Amoli A, Mégarbane B, Chabriat H. La leucoencéphalopathie postérieure réversible. Reanimation 2007 ;16 :490-7.
16. Schwartz RB. Hyperperfusion encephalopathies: hypertensive encephalopathy and related conditions. Neurologist 2002;8:22-34.
17. Kabre RS, Kamble KM. Gemcitabine and Cisplatin induced posterior reversible encephalopathy syndrome: A case report with review of literature. J Res Pharm Pract 2016;5(4):297-3s00.
18. Lv C, Gao B Serum lactate dehydrogenase as a predictor of outcome in posterior reversible encephalopathy syndrome: imperative to unify. AJNR Am J Neuroradiol. 2015;36(4):29-30.