Igala M1, Matongo Mugueni J2, Ntsame Ndong JM2, Rebienot Pellegrin O2, Ovono Abessolo F3.
1- Département de médecine et spécialités médicales, Université des Sciences de la Santé
2- Centre National de Transfusion Sanguine
3- Département de chimie biochimie, Université des Sciences de la Santé
Auteur correspondant :
Marielle Igala Bp 14485 Libreville email : mariligalase@yahoo.fr
Résumé
Introduction : les valeurs de référence peuvent être obtenues à partir des bases de données. Nous nous proposons de produire ces valeurs à partir d’une base de données hématologiques et de souligner les contraintes inhérentes à cette méthodologie.
Matériel et méthodes : Il s’agit d’une étude rétrospective, réalisée du 1er janvier 2015 au 30 mars 2017, au Centre National de Transfusion Sanguine de Libreville. Les dossiers des donneurs, dont les sérologies (HIV, AgHBs, Ac HVC, VDRL et TPHA) étaient négatives ont été retenus. Les paramètres de l’hémogramme ont été notés pour chaque dossier. L’identification des valeurs aberrantes a été réalisée à l’aide de la méthode de Cook, la nature de la distribution a été étudiée grâce au test de normalité de Shapiro-Wilk. Les limites de référence à 95% et leurs intervalles de confiance à 90% ont été calculés. La recherche des partitions a été effectuée à l’aide du z-test. Les différences étaient considérées comme statistiquement significatives, pour une valeur de p inférieure à 0,05.
Résultats : ce protocole a concerné 27022 dossiers, dont 2013 (7,4%) ont été exploités. L’intervalle de référence à 95% des leucocytes allait de 2,8.103 à 6,1.103/mm3, alors que celui des hématies allait de 4,3.106 à 5,3.106/mm3 et celui des plaquettes de 129,7.103 à 258,0.103/mm3. De plus, les hématies allaient de 4,4.106 à 5,3.106/mm3 chez les hommes contre 4,4.106 à 5,1.106/mm3 pour les femmes de même tranche d’âge.
Conclusion : la réalisation d’une telle étude nécessite une collaboration interdisciplinaire, une bonne tenue des bases de données et nous rappelle la primauté d’une différence biologique, par rapport à une différence statistique.
Mots clés : valeurs référence – hémoglobine – Hématies – Leucocytes – Plaquettes
Abstract
Introduction: Reference values can be obtained from databases. We propose to produce these values from a hematological database and to underline the constraints of that methodology.
Material and methods: This was a retrospective study, carried out from January 1, 2015 to March 30, 2017, at the National Blood Transfusion Center in Libreville. The study population consisted of records of new or old blood donors, voluntary or family, whose serologies (HIV, HBsAg, Ac HVC, VDRL and TPHA) were negatives. The blood count parameters were noted for each record. The identification of outliers was done using Cook’s method, the nature of the distribution was investigated using the Shapiro-Wilk normality test. The 95% reference limits and their 90% confidence intervals were calculated. The partition study was performed using the z-test. Differences were considered statistically significant, for a p-value less than 0.05.
Results: this protocol concerned 27,022 cases, of which 2013 (7.4%) were used. The 95% reference interval of leukocytes ranged from 2.8.103 to 6.1.103 / mm3, while that of red blood cells ranged from 4.3.106 to 5.3.106 / mm3 and that of platelets from 129.7.103 to 258.0.103 / mm3.
Conclusion: Carrying out such a study requires interdisciplinary collaboration, good database maintenance and reminds us of the primacy of a biological difference over a statistical difference.
Key words: reference values – hemoglobin – Red blood cells – Leukocytes – Platelets
Introduction
Les valeurs de référence anciennement appelées «valeurs normales», se définissent comme les différentes valeurs obtenues par l’observation ou la mesure d’une quantité définie sur un individu dit de référence. L’ensemble de ces valeurs, pour un même marqueur, constitue l’intervalle de référence [1]. Ce dernier est défini par une valeur supérieure et une autre inférieure, les limites de référence. Mais dans certains cas, seule la limite de référence inférieure ou supérieure peut être retenue [1]. Ces valeurs permettent de fixer une limite de décision adaptée à chaque patient, d’alerter le patient sur les risques encourus, de confirmer un diagnostic médical, ou encore de dépister une affection cliniquement non décelable [2]. Cependant, les valeurs de référence sont influencées par plusieurs facteurs, dont les facteurs physiologiques, socio-démographiques, génétiques et environnementaux [3-6]. Ces facteurs sont responsables des variations biologiques qui, lorsqu’elles ne sont pas prises en compte, peuvent influencer la production des valeurs de référence [7].
C’est pour cette raison que les sociétés savantes, notamment la norme ISO 15189, stipulent que les valeurs de référence doivent être périodiquement révisées et qu’il incombe à chaque laboratoire ou aux
réseaux de laboratoires, d’utiliser les valeurs de référence adaptées à leur méthodologie et à leur population [8].
Le protocole de détermination des valeurs de référence est parfaitement codifié par la Fédération Internationale de Chimie Clinique. Il part de la sélection des individus de référence, appartenant à une population homogène, dont les caractères sont suffisamment décrits [9]. Cette sélection peut se faire a priori, c’est-à-dire que les critères de sélection se basent sur les données de la littérature et 50 à 150 individus de référence sont sélectionner pour chaque classe. La sélection peut aussi se faire a posteriori, dans ce cas, la sélection des individus de référence se fait après administration d’un questionnaire, à partir de critères d’inclusion. Contrairement à la précédente méthode, la sélection a posteriori des
individus de référence se fait à partir d’une population tout-venant, de plus de 1000 sujets [10-11].
L’échantillonnage peut aussi être indirect. Dans ce cas, les informations contenues dans une base des données d’un laboratoire ou d’un hôpital sont utilisées. L’extraction des données est réalisée par des méthodes statistiques, après élimination des valeurs aberrantes [1,10,12]. Ce procédé est relativement simple et peu couteux et donc approprié pour les laboratoires africains.
En effet, en Afrique comme dans le monde, l’établissement des valeurs de référence ou la vérification de ces valeurs de référence a pris un essor avec plusieurs études [13-20]. De même au Gabon, Humberg Alexander [21] a traité des valeurs de l’hémogramme chez l’enfant. Par contre, chez l’adulte, ces données ne sont pas disponibles, conduisant les laboratoires et praticiens à utiliser les valeurs de référence fournies par les fabricants d’auto analyseurs. Dans ce travail, nous nous proposons de calculer les valeurs de référence à l’aide d’un échantillonnage indirect, et à mettre en évidence les difficultés pratiques de cette méthodologie, en prenant comme exemple les paramètres de l’hémogramme chez l’adulte.
Matériel et méthodes
Il s’agit d’une étude rétrospective, réalisée du 1er janvier 2015 au 30 mars 2017. Elle a été menée au Centre National de Transfusion Sanguine (CNTS) de Libreville qui est le centre de référence de la collecte, de la production et de la distribution des produits sanguins labiles au Gabon.
Les donneurs de sang bénéficiaient d’une consultation pré-don, après avoir rempli une fiche de renseignements. Cette fiche comportait les informations en relation avec les antécédents médicaux, chirurgicaux, de transfusion ou gynécologiques (pour les femmes). En outre, la fiche renseignait sur la notion de contact avec le sang humain, les conduites sexuelles à risque et la présence de tatouages ou la pose des boucles d’oreilles récentes (datant de moins de 6 mois). Elle précisait aussi, la notion de fièvre, de diarrhée ou de prise de médicament les 3 jours qui ont précédé le prélèvement. A l’issu de cet entretien pré-don, les donneurs étaient enregistrés avec un numéro d’identification. Cette étude a été réalisée dans le respect des recommandations éthiques de Helsinki [22].
Le prélèvement veineux était fait au pli du coude chez un sujet au repos depuis 5 minutes, assis sur un fauteuil incliné à 30°, avec un garrot peu serré. Trois tubes étaient ainsi remplis par 4 mL de sang (un tube EDTA et deux tubes sec). Les prélèvements étaient immédiatement transportés dans des portoirs vers l’unité d’hématologie-immunologie et de virologie pour la réalisation respectivement de l’hémogramme et des sérologies infectieuses. Les tubes secs ont été centrifugés puis conservés à température ambiante. L’analyse a été faite au maximum 24 heures après le prélèvement.
Le screening biologique
Tous les spécimens ont bénéficié d’un test de dépistage portant sur quatre infections. Le premier portait sur l’infection au VIH par la recherche d’antigène et d’anticorps du VIH en utilisant les réactifs Genscreen™. ULTRA HIV Ag-Ab. Le second portait sur l’hépatite C par la recherche de l’antigène et l’anticorps HCV en utilisant les réactifs Monolisa HCV Ag-Ab ULTRA V2. Le troisième concernait l’Hépatite B par la recherche de l’antigène HBs, en utilisant les réactifs Monolisa™ HBs Ag ULTRA tests. L’infection syphilitique a été recherchée en utilisant les réactifs tests Syphilis Total.
L’analyse hématologique
Elle a été effectuée grâce à l’automate HUMA count 5L de type Human mis en service dès le 01 er janvier 2015 (jusqu’à la fin de l’étude). Il utilise l’impédance comme méthode d’analyse. Les paramètres évalués étaient : le taux des leucocytes, le taux des hématies, l’hématocrite (Hte), le taux d’hémoglobine (Hb), le volume globulaire moyen (VGM), la concentration corpusculaire moyenne en
hémoglobine (CCHM), la teneur corpusculaire moyenne en hémoglobine (TCMH) et le nombre des plaquettes (PLT).
Le contrôle de qualité interne était effectué quotidiennement pour chaque paramètre. En ce qui concerne la virologie, il était effectué chaque matin en utilisant trois tubes : un témoin positif et un témoin négatif (les deux fournis par le fabriquant) et un troisième tube connu témoin positif produit par le laboratoire. Pour l’hématologie, trois niveaux de contrôle de qualité interne étaient utilisés, un niveau
normal, un contrôle « haut » et un contrôle « bas ».
Population de référence
La population d’étude était constituée des donneurs de sang, nouveaux ou anciens, volontaires ou familiaux en bonne santé. Tous les donneurs de sang adultes des deux sexes qui avaient un poids supérieur ou égal à 50 kilogrammes et âgés de 18 à 60 ans ont été inclus dans l’étude. Deux tranches d’âge ont été définies, une allant de 18 à 29 ans et l’autre de 30 à 60 ans. Les donneurs de sang qui présentaient une contre-indication au don de sang, ceux dont au moins l’une des sérologies était positive (HIV, AgHBs, Ac HVC, VDRL et TPHA), les donneurs dont les dossiers étaient incomplets n’ont pas été retenus dans ce travail.
Les données recueillies ont été consignées dans une fiche d’enquête. Les paramètres étudiés étaient sociodémographiques et biologiques. Les variables qualitatives nominales étaient le sexe et le groupe sanguin. La variable quantitative était l’âge (en années). Sur le plan biologique, les variables quantitatives étaient le nombre des leucocytes (106/mm³), le nombre de globules rouges (en 109 par mm3, l’hématocrite (%), le taux d’hémoglobine (g/dL), le volume globulaire moyen (fL), la concentration corpusculaire moyenne en hémoglobine (%), la teneur corpusculaire moyenne en hémoglobine (pg/cellule), et le nombre de plaquettes (103/mm³).
Collecte, traitement et analyse des données
Les données se trouvaient dans deux bases différentes, une pour l’hématologie et l’autre pour les sérologies. La première étape a consisté à associer ces deux bases de données. Le traitement et l’analyse ont été effectués en utilisant le logiciel R version3.4.2 et le tidyverse packages pour la combinaison des deux bases, permettant ainsi de retirer les sujets dont au moins une des sérologies étaient positive. L’identification des valeurs aberrantes a été réalisée à l’aide de la méthode de Cook, en utilisant la formule suivante : 𝑑𝑖cook =r2𝑖H𝑖𝑖/𝑝(1−𝐻𝑖𝑖). Si cette distance était supérieure à 1, alors l’observation en question avait une influence dans la détermination de la variable et pouvait donc être supprimée. La vérification de la nature de la distribution a été réalisée à l’aide du test de normalité de Shapiro-Wilk. Les méthodes non paramétriques ont été utilisées pour déterminer les limites de référence à 95% et leurs Intervalles de Confiance à 90%. Le test de Mann-Whitney a permis de choisir les variables à inclure dans le Z-test pour tester si la partition d’une variable était nécessaire en fonction des tranches d’âge ou du sexe. Seules les variables pour lesquelles la probabilité p était inférieure à 0,05 pour le test de Mann-Whitney, ont été incluses dans le Z-score. Les variables pour lesquelles le Z-score était inférieur à la limite calculée ont été partitionnées. Les différences étaient considérées comme statistiquement significatives, pour une valeur de p inférieure à 0,05.
Résultats
La mise en oeuvre de ce protocole a concerné 27022 dossiers, dont 11000 étaient incomplets et 1000 avaient au moins une sérologie positive. L’élimination des valeurs aberrantes a concerné 12047 dossiers, ce qui a abouti à une population de travail de 2013 sujets, dont1923 (95,5%) étaient des hommes. Par ailleurs, 1108 (55,0%) étaient âgés de plus de 30 ans.
Les données brutes retirées des bases de données ont montré une importante variabilité, avec des écarts types importants. Cette variabilité a été réduite après élimination des valeurs aberrantes. Ainsi, les concentrations des leucocytes sont passées de 5,5±55,0.103/mm3, à 4,4±0,7.103/mm3.
De même, les concentrations des plaquettes initialement à 211,4±70,9.103/mm3, se sont retrouvées à 194,3±34,9.103/mm3. Par contre, les valeurs absolues en elles-mêmes ont été peu modifiées, en dehors de la concentration des hématies qui a été réduite de moitié, passant de 7,0±90,7.106/mm3, à 4,8±0,3.106/mm3 (tableau I).
Dans l’ensemble, aucun des paramètres ne présentait une distribution normale, comme spécifié dans le tableau II.
Tableau I : répartition des valeurs moyennes des paramètres hématologiques avant et après élimination des valeurs aberrantes

Tableau II : résultats du test de Shapiro-Wilk pour la vérification de la nature de la distribution des paramètres étudiés
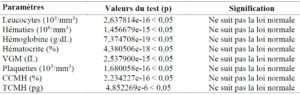
Les intervalles de référence qui ont été obtenus dans cette étude sur la population globale, ont été consignés dans le tableau III. L’intervalle de référence à 95% des leucocytes allait de 2,8.103 à 6,1.103/mm3, alors que celui des hématies allait de 4,3.106 à 5,3.106/mm3 et celui des plaquettes allait de 129,7.103 à 258,0.103/mm3.
Tableau III : intervalles de référence à 95% et leurs intervalles de confiance à 90% dans la population générale.

Les résultats des tests de partition des données en fonction de l’âge et du sexe ont été résumés dans le tableau IV. La plupart des paramètres des hématies pouvait être partitionnés. Par contre, cette partition ne semblait utile ni pour le taux d’hémoglobine, l’hématocrite et le CCMH pour le sexe, ni pour le VGM pour l’âge. Après la partition des sujets en fonction du sexe et l’âge, les valeurs de référence obtenues ont été consignées dans le tableau V. Les écarts les plus importants, pouvant présenter un éventuel impact clinique, concernaient les taux des plaquettes. En effet, chez les hommes, les plaquettes allaient de 133,0 à 257,0.103/mm3, contre 146,0 à 268,0.103/mm3 chez les femmes appartenant à la même tranche d’âge. Par contre, le taux des hématies allait de 4,4.106 à 5,3.106/mm3 chez les hommes de 18 à 29 ans, alors que ce taux allait de 4,4.106 à 5,1.106/mm3 chez les femmes de la même tranche d’âge.
Tableau IV : résultats du test de Mann-Whitney et du Z test selon le genre et l’âge

Tableau V: intervalles de référence de l’hémogramme, selon l’âge et le genre

Conclusion
Ce travail avait pour but la détermination des valeurs de référence de l’hémogramme dans une population d’adultes donneurs de sang. La procédure utilisée nécessite une collaboration intense entre biologistes.
En effet, les paramètres de l’hémogramme sont utilisés par toutes les spécialités médicales car il s’agit d’un examen de routine, réalisé dans tout laboratoire de biologie médicale. Cette collaboration s’étend aux statisticiens car les calculs impliqués peuvent paraître particulièrement complexe pour un biologiste isolé [23]. La collaboration dont il est question ici suppose également une bonne tenue des bases de données qui sont des outils importants pour la réalisation des études observationnelles, telle que celle qui a été menée dans ce travail. Dans le cas contraire, comme cela a été notre cas, les données utilisables concernaient 2013 dossiers, sur 27022, soit 7,4% seulement. Ceci a eu pour conséquence de réduire la précision attendue pour les résultats de cette étude. De même, le mode de recrutement des donneurs de sang a conduit à une asymétrie de la distribution de la population selon le genre, car plus de 95% des sujets de ce travail étaient des hommes, alors que la population à laquelle devraient s’appliquer ces valeurs de référence n’est pas aussi asymétrique. Cette proportion d’hommes viendrait seulement du fait que les donneurs de sang sont généralement des donneurs familiaux et volontaires, principalement de sexe masculin. En effet, ce sont les membres de la famille les plus âgés qui viennent pour compenser la poche de sang alors que les sujets de moins de 30 ans font des dons bénévoles et ce, après sensibilisation en milieu scolaire ou professionnel. Néanmoins et malgré ces difficultés, les valeurs de référence obtenues ne comportent aucune valeur aberrante, du point de vue clinique. Cependant, la partition réalisée sur la base des tests statistiques (Mann Whitney et Z-test), a un intérêt statistique, mais la pertinence biologique laisse à désirer. En effet, un paramètre comme le taux d’hématies, partitionné selon le genre et les tranches d’âge, a des intervalles de référence qui vont de 4,4 à 5,3 chez les hommes âgés de 18 à 29 ans, contre 4,4 à 5,1 chez les femmes appartenant à la même tranche d’âge. Différencier ces intervalles ne semble pas utile pour le praticien. Il en est de même pour les autres paramètres de l’hémogramme. Par ailleurs, la mise en évidence de différences statistiques très faibles peut également être due à la taille de l’échantillon utilisé. En effet, le groupe des hommes,
comme déjà signalé, comportait près de 1912 sujet, soit une valeur nettement supérieur à la valeur de 120 généralement recommandée. Les valeurs de référence ont donc été regroupées dans le tableau comparatif (tableau VI), sans tenir compte de la partition. Comme il apparaît dans ce tableau, les donneurs de sang ont été utilisés par Oloume au Cameroun [24] et Messanh au Togo [25]. Le choix de cette population repose sur l’hypothèse qu’elle serait en bonne santé. Par ailleurs, ils bénéficient également d’une consultation médicale avec un interrogatoire pré-don, permettant d’éliminer les sujets atteints de pathologies diverses.
Tableau VI: Intervalles de référence de notre étude en comparaison avec d’autres pays africains

Les valeurs de référence des leucocytes sont plus basses que celles proposées par les fabricants des auto analyseurs (4000 – 10.000/mm3). Un résultat similaire a été observé à Yaoundé au Cameroun alors que dans les études malienne et togolaise seules les limites inférieures sont basses [24-26]. Ceci serait dû à la situation d’inflammation et d’infections chroniques que connaissent nos populations, les rendant plus réfractaires à une augmentation des leucocytes, même devant une infection. Une autre explication serait un excès de margination des polynucléaires neutrophiles. La réalisation d’une formule leucocytaire aurait certainement permis de mieux vérifier cette hypothèse. Le taux d’hémoglobine variait peu, non seulement en fonction du genre, mais également en fonctions des tranches d’âges. Ceci devrait amener à moduler les valeurs caractérisant une anémie ou une polyglobulie dans cette population. Par contre, Mugisha et al. ont mis en évidence une différence du taux
d’hémoglobine selon le genre et l’âge [20]. Ici encore, la justification de cette différence viendrait de l’asymétrie de la population de travail.
De même, le taux de plaquettes obtenues était encore plus bas par rapport à l’intervalle généralement utilisé dans les laboratoires d’analyse médicale. Pour ce paramètre, le caractère pincé de l’intervalle obtenu dans cette étude et celle de Oloume au Cameroun, pourrait venir de l’infection à Plasmodium falciparum endémique dans ces pays.
Conclusion
Cette étude a montré toute la complexité de l’établissement des valeurs de référence à partir d’une base de données. Néanmoins, les résultats obtenus sont relativement comparables à ceux des autres pays. Cependant, à partir de ces données, un travail d’établissement des valeurs de référence, en mode prospectif est indispensable. Il est également possible, de vérifier les valeurs de référence retrouvées dans ce travail, puisque dans ce cas, les contraintes en terme de nombre de sujets par groupe peuvent être facilement gérer.
Références
2. Siest G, Henny J, Guize L, et al. Utilisation des valeurs de référence. Société Française de Biologie clinique, Commission Valeurs de Référence. Ann Biol Clin 1982;40:697-708.
3. The international federation of clinical chemistry. Approved recommendation (19%) on the theory of reference values Part 1. The concept of reference values. CIinica Chimica Acta 1987;16:111-8.
4. Grefffe A, Friedrichs K, Harr K, et al. Reference values: A Review. Vet Clin Path 2009;38(3):288-98.
5. Timzing M, Osawe S, Tokdung M, et al. Comprehensive Reference Ranges for Hematology and Clinical Chemistry Laboratory Parameters Derived from Normal Nigerian Adults. PloS ONE 2014;9(5):e93919.doi:10.1371/journal.pon e.0093919.
6. Aregawi Y, Betelihem T, Meseret A, et al. Hematological reference intervals determination in adults at Gondar university hospital, Northwest Ethiopia. BMC Res Notes 2016;9:483.
7. Boyd JC. Cautions in the adoption of common reference intervals. Clin Chem 2008;54(2):238-239.
8. Bretaudière JP, Buret J, Siest G, et al. Variations biologiques des examens de laboratoires. Société Française de Biologie Clinique, Commission Valeurs de Référence. Ann Biol Clin 1979;37:229-39.
9. Zlata F, Sonja P, Andrea R. Standardization in laboratory medicine: Adoption of common reference intervals to the Croatian population. World J Methodol 2016;6(1):93-100.
10. CLSI Document C28-A3:2008. Definishing, establishing, and verifying reference intervals in the clinical laboratory; approved guidelines 3 edition 2008;8.
11. Troussard X, Vol S, Cornet E, et al. Etude des valeurs normales de l’hémogramme l’adulte: un besoin pour une meilleure interprétation et pour l’accréditation du laboratoire. Ann Biol Clin 2014;72(5):561-81.
12. Solberg HE, Ari L. Detection of outliers in reference distributions: performance of Horn’s algorithm. Clin Chem 2005;51(12):2326-32.
13. Menard D, Mandeng M J, Bem TM, et al. Immunohematological Reference Ranges for Adults from the Central African Republic. Clinical and Diagnostic Laboratory Immunology 2003;3(10):443–445.
14. Lugada ES, Mermin J, Kaharuza F, et al. Population-based hematologic and immunologic reference values for a healthy Ugandan population. Clin Diagn Lab Immunol 2004;11:29–34.
16. Tembe N, Orvalho J, Alfai E, et al. Reference Values for Clinical Laboratory Parameters in Young Adults in Maputo, Mozambique. PloS ONE 2014;5(9):1-11.
17. Chisale MR, Kumwenda P, Ngwira M, et al. A pilot study to determine the normal haematological indices for young Malawian adults in Blantyre, Malawi. Malawi Medical Journal 2015;27(3):96-100.
18. Odhiambo C, Oyaro B, Odipo R. Evaluation of Locally Established Reference Intervals for Hematology and Biochemistry Parameters in Western Kenya. Plos One 2015;13:1-10.
19. Aregawi Y, Betelihem T, Meseret A, et al. Hematological reference intervals determination in adults at Gondar university hospital, Northwest Ethiopia. BMC Res Notes 2016;9:483.
20. Mugisha JO, Seeley J, Kuper H. Population based haematology reference ranges for old people in rural SouthWest Uganda. BMC Res Notes 2016;9:433.
21. Humberg A, Kammer J, Mordmuller B, et al. Haematological and biochemical reference intervals for infants and children in Gabon. Trop Med Int Health 2011;16(3):343–8.
22. World Medical Association. World Medical Association Declaration of Helsinki: ethical principles for medical research involving human subjects. JAMA 2013;310(20):2191-4.
23. Hoq M, Matthews S, Karlaftis V, et al. Reference values for 30 common biochemistry analytes accross 5 differents analyzers in neonates and children 30 days to 18 years of age. Clin Chem 2019;65(10):1317-26.
24. Oloume ME, Mouliom A, Melingui BF, et al. Haematological values in a healthy adult population in Yaoundé, Cameroon. Afr J Lab Med 2019;8(1): 852.doi :10.4102/ajlm.v8i1.852.
25. Messanh KI, Akuete SY, Jouault H, et al. Hematological Reference Values for Healthy Adults in Togo. ISRN Hematol 2011;2011 :736062.doi :10.5402/2011/736062.
26. Kone B, Maiga M, Baya B, et al. Establishing Reference Ranges of hematological parameters from Malian Healthy Adults. J Blood Lymph 2017.doi :10.472/2165-7831.1000154.